Устройство атома - одна из важнейших тем в физике и химии. Атомы являются основными строительными блоками всего материального мира и представляют собой невероятно сложные системы. Одним из ключевых параметров атома является заряд ядра.
Заряд ядра определяет количество протонов в атоме и имеет решающее значение для его химических свойств и взаимодействий с другими атомами. Он влияет на расположение электронов в атоме, а следовательно, и на способность атома образовывать химические связи и реагировать с другими веществами.
Чем больше заряд ядра, тем сильнее его притяжение электронов и тем сложнее электронам двигаться. Это может привести к тому, что атом будет образовывать более крепкие связи с другими атомами или ионами. Поэтому атомы с большим зарядом ядра обычно имеют более высокую реакционную способность и могут образовывать более стабильные ионные связи.
Заряд ядра атома: важность и влияние
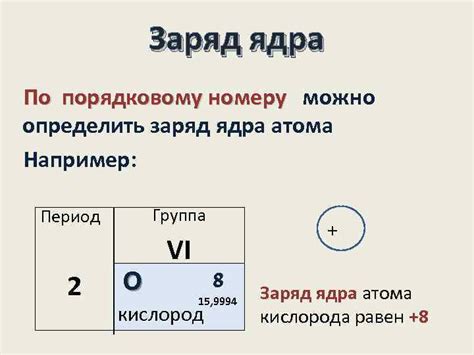
Заряд ядра атома также определяет его положение в периодической системе элементов. Номер элемента в периодической системе соответствует количеству протонов, то есть заряду ядра данного атома. Это позволяет классифицировать элементы и предсказывать их химические свойства. Например, элементы с одинаковым зарядом ядра (такие как все элементы с атомным номером 6 - углерод, 14 - кремний, 26 - железо и так далее) обладают схожими химическими свойствами и часто образуют однотипные соединения.
Заряд ядра также влияет на размер атома. Чем больше заряд ядра, тем сильнее электростатическое притяжение и тем компактнее будет атом. Напротив, меньший заряд ядра ослабляет электростатическое притяжение и позволяет электронам находиться на большем расстоянии от ядра, делая атом более объемистым.
Заряд ядра также может влиять на реакционную способность атома. Электроны, находящиеся на внешней оболочке атома, определяют его химическую активность и взаимодействия с другими атомами. Чем сильнее электростатическое притяжение электронов к ядру, тем сложнее будет отделить эти электроны и, следовательно, тем менее реакционноспособным будет атом.
В целом, заряд ядра атома играет доминирующую роль в его химической активности, взаимодействии с другими атомами и образовании соединений. Понимание этого явления позволяет лучше понять и объяснить многие химические процессы и свойства веществ.
Заряд ядра и его влияние на химические свойства
В основе химических свойств атомов лежит возможность образования химических связей с другими атомами. Заряд ядра определяет силу электростатического взаимодействия и, следовательно, вероятность образования химической связи. Чем больше заряд ядра, тем сильнее притягиваются электроны к нему, что способствует образованию более крепких химических связей.
Заряд ядра также влияет на энергию образования химических связей и, следовательно, на энергию химических реакций. Вещества с атомами с большим зарядом ядра имеют более высокую энергию связи и, как правило, более стабильны. Это может влиять на их степень реакционной активности и возможность участия в химических превращениях.
Заряд ядра также играет роль вопроса образования ионов. Атом с положительным зарядом ядра может потерять один или несколько электронов и стать ионом с положительным зарядом. Атом с отрицательным зарядом ядра, наоборот, может принять дополнительные электроны и стать ионом с отрицательным зарядом.
Таким образом, заряд ядра имеет решающее значение для понимания химических свойств атома. Он определяет силу взаимодействия, энергию связи, возможность образования ионов и, в конечном счете, химическую активность атома.
Взаимодействие заряда ядра с внешними электронами

Заряд ядра атома играет важную роль во взаимодействии с внешними электронами. Ядро атома содержит положительно заряженные протоны и нейтроны без заряда. Этот положительный заряд ядра притягивает отрицательно заряженные электроны, находящиеся на электронных оболочках вокруг ядра.
Взаимодействие заряда ядра с внешними электронами определяет химические свойства атома. Чем больше заряд ядра, тем сильнее он притягивает электроны и тем стабильнее атом. В результате этого взаимодействия формируются химические связи между атомами, обеспечивающие образование молекул и соединений.
Заряд ядра определяет также электронную оболочку атома. Электроны находятся на разных энергетических уровнях вокруг ядра, образуя электронные оболочки. Каждая оболочка может содержать определенное количество электронов. Чем ближе электронная оболочка к ядру, тем более сильно электроны в ней притягиваются зарядом ядра и тем меньше энергии у этих электронов.
Изменение заряда ядра, например, при изменении числа протонов, приводит к изменению химических свойств атома. Этот факт используется, например, в радиоактивных процессах, где происходит распад ядра атома, сопровождающийся изменением его заряда и связанными с этим изменениями химических свойств.
| Важные моменты: | Содержание |
|---|---|
| Заряд ядра | Играет важную роль во взаимодействии с внешними электронами |
| Взаимодействие | Определяет химические свойства атома и образование молекул и соединений |
| Электронные оболочки | Формируются в результате взаимодействия заряда ядра с электронами |
| Изменение заряда | Ведет к изменению химических свойств атома, использование в радиоактивных процессах |
Влияние заряда ядра на кислотность и основность веществ

Заряд ядра атома оказывает существенное влияние на его химические свойства, включая его способность выступать в роли кислоты или основания. Кислотность и основность вещества определяются его способностью отдавать или принимать протоны.
Вещества, которые могут легко отдавать протоны, считаются кислотами. Они обладают положительным зарядом ядра, что делает их способными привлекать электроны в своей электронной оболочке. Когда кислота взаимодействует с другим веществом, она отдает протон, образуя отрицательно заряженный ион. Примерами кислот могут служить соляная кислота (HCl) или уксусная кислота (CH3COOH).
С другой стороны, вещества, которые могут легко принимать протоны, считаются основаниями. Они обладают отрицательным зарядом ядра и имеют свободные электроны, способные принять протон. Когда основание взаимодействует с кислотой, оно принимает протон, образуя положительно заряженный ион. Примерами оснований являются гидроксид натрия (NaOH) и аммиак (NH3).
Таким образом, заряд ядра атома непосредственно влияет на его способность выступать в роли кислоты или основания. Чем больше заряд ядра, тем сильнее притяжение протонов к электронам вещества и тем больше его кислотность. С другой стороны, чем меньше заряд ядра, тем больше свободных электронов вещества и тем больше его основность.
| Вещество | Кислотность/основность |
|---|---|
| Соляная кислота (HCl) | Кислота |
| Уксусная кислота (CH3COOH) | Кислота |
| Гидроксид натрия (NaOH) | Основание |
| Аммиак (NH3) | Основание |
Изучение влияния заряда ядра на кислотность и основность веществ имеет важное значение в химии и позволяет предсказывать и объяснять множество химических реакций и свойств веществ.
Влияние заряда ядра на химическую активность и реакционную способность
Чем больше заряд ядра, тем сильнее притяжение электронов и, соответственно, тем более стабильной является атомная система. Это связано с тем, что электроны имеют тенденцию находиться как можно ближе к ядру, где сила притяжения сильнее. В результате, атомы с большим зарядом ядра имеют меньший радиус и более плотно держат свои электроны, что делает их менее склонными к реакциям.
С другой стороны, атомы с малым зарядом ядра имеют больший радиус и слабее удерживают свои электроны. В результате, они более склонны к химическим реакциям и взаимодействию с другими атомами. Это делает их более химически активными и способными к образованию химических соединений с другими элементами.
| Заряд ядра | Реакционная способность | Химическая активность |
|---|---|---|
| Большой | Низкая | Низкая |
| Малый | Высокая | Высокая |
При изучении химических свойств атомов и их взаимодействия, заряд ядра следует учитывать как один из ключевых факторов, влияющих на реакционную способность и химическую активность атомов. Это позволяет лучше понять и описать свойства элементов и их взаимодействие в химических реакциях.
Связь заряда ядра с радиоактивным распадом

Заряд ядра играет решающую роль в механизме радиоактивного распада. Нейтроны и протоны, составляющие ядро атома, взаимодействуют между собой с помощью электромагнитной силы. Сила, с которой эта сила действует на частицы, зависит от их заряда. Чем больше заряд ядра, тем сильнее электромагнитное взаимодействие между нуклонами.
При достаточно большом заряде ядра, отталкивательная сила между протонами становится настолько сильной, что она превышает силу ядерного сцепления и ядро становится нестабильным. В результате этого нестабильного состояния ядро испытывает радиоактивный распад в попытке достичь более стабильной конфигурации.
Таким образом, заряд ядра непосредственно связан с вероятностью и скоростью радиоактивного распада. Более высокий заряд ядра ускоряет процесс радиоактивного распада, а более низкий заряд может существенно замедлить или даже полностью подавить этот процесс.
Заряд ядра и его влияние на структуру и свойства элементов Периодической системы
Заряд ядра влияет на электронную оболочку атома. Электроны обращаются вокруг ядра на разных энергетических уровнях и обладают отрицательным зарядом. Сила притяжения между электронами и положительно заряженным ядром определяет структуру атома и распределение электронов по оболочкам.
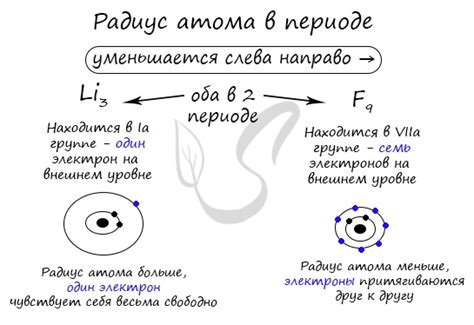
Заряд ядра влияет на атомный радиус. Атомный радиус уменьшается с увеличением заряда ядра. Это объясняется тем, что сильное притяжение ядра сжимает электронную оболочку, делая атом более компактным. Влияние заряда ядра на атомный радиус наблюдается в пределах одной периодической группы: атомы с большим зарядом ядра имеют меньший атомный радиус, чем атомы с меньшим зарядом ядра.
Заряд ядра также влияет на электроотрицательность элемента. Электроотрицательность - это свойство атома притягивать электроны в химических соединениях. Электроотрицательность элемента увеличивается с увеличением заряда ядра. Элементы с большим зарядом ядра имеют большую электроотрицательность и являются хорошими окислителями, тогда как элементы с меньшим зарядом ядра имеют меньшую электроотрицательность и являются хорошими восстановителями.
Таким образом, заряд ядра играет основополагающую роль в определении структуры и химических свойств элементов Периодической системы. Он определяет распределение электронов по энергетическим оболочкам, атомный радиус и электроотрицательность элементов. Понимание влияния заряда ядра позволяет лучше понять химическую активность элементов и их взаимодействие в химических соединениях.
Влияние заряда ядра на ионизационный потенциал и радиус атома
Заряд ядра, определяющий его электростатическое взаимодействие с электронами, играет важную роль в химических свойствах атомов. В частности, заряд ядра оказывает существенное влияние на ионизационный потенциал и радиус атома.
Ионизационный потенциал – это энергия, необходимая для удаления одного электрона из атома. Он зависит от заряда ядра и от расстояния между электроном и ядром. Если заряд ядра увеличивается, то электростатическое притяжение к ядру усиливается, и, следовательно, энергия, необходимая для удаления электрона, возрастает. Таким образом, ионизационный потенциал возрастает с увеличением заряда ядра.
Также заряд ядра влияет на радиус атома. Радиус атома определяется расстоянием между ядром и наиболее удаленным от ядра электроном. При увеличении заряда ядра происходит сжатие электронного облака, так как электроны притягиваются сильнее. Следовательно, радиус атома уменьшается при увеличении заряда ядра.
Таким образом, заряд ядра играет определяющую роль в химических свойствах атомов. Увеличение заряда ядра приводит к повышению ионизационного потенциала и уменьшению радиуса атома. Эти изменения оказывают существенное влияние на процессы взаимодействия между атомами и формирование химических связей.
Заряд ядра атома и его роль в формировании валентной электронной конфигурации
Заряд ядра атома играет важную роль в формировании валентной электронной конфигурации. Валентная электронная конфигурация определяет химические свойства атома и определяет, как атом будет взаимодействовать с другими атомами.
Заряд ядра атома определяется количеством протонов в нем. Протоны имеют положительный электрический заряд, а электроны имеют отрицательный заряд. Заряд ядра атома привлекает электроны к себе, создавая электростатическое притяжение между ядром и электронами.
Валентные электроны - это электроны, находящиеся на внешнем энергетическом уровне атома. Они определяют химические свойства атома и его способность образовывать химические связи с другими атомами. Количество валентных электронов в атмосфере напрямую связано с зарядом ядра атома.
Заряд ядра атома влияет на тенденцию валентных электронов к участию в химическом взаимодействии. Атомы с положительным зарядом ядра будут притягивать электроны из других атомов, тем самым образуя ионные связи. Атомы с отрицательным зарядом ядра будут обладать большей тенденцией отдавать свои валентные электроны, что приведет к образованию ковалентной и металлической связей.
Таким образом, заряд ядра атома играет решающую роль в его химическом взаимодействии. Он определяет степень притяжения валентных электронов и влияет на их участие в образовании химических связей. Понимание роли заряда ядра позволяет лучше понять химические свойства атомов и их поведение при взаимодействии с другими атомами.



