Азот – это химический элемент с атомным номером 7 и символом N. Он является одним из самых распространенных элементов в природе и существенной составляющей многих органических соединений. В то же время, азот может иметь различные валентности и степени окисления, что обусловлено его электронной структурой и образованием различных соединений.
Валентность азота 4 говорит о том, что атом азота может образовывать четыре химические связи с другими атомами. Это свойство делает азот и его соединения структурно разнообразными и полезными в различных биологических и промышленных процессах. В частности, азот с валентностью 4 может быть частью аминокислот, нуклеотидов и других органических соединений, играющих важную роль в жизни организмов.
Степень окисления азота 5 указывает на то, что атом азота потерял пять электронов и имеет положительный заряд. Такое состояние азота встречается, например, в некоторых оксидах азота, где он образует связь с пятью кислородными атомами. Эти оксиды азота имеют важное применение в различных отраслях промышленности, например, в производстве удобрений и смесей для воздушного растворения. Благодаря высокой степени окисления, азот в таких соединениях обладает более сильными окислительными свойствами.
Азот валентность 4 и степень окисления 5
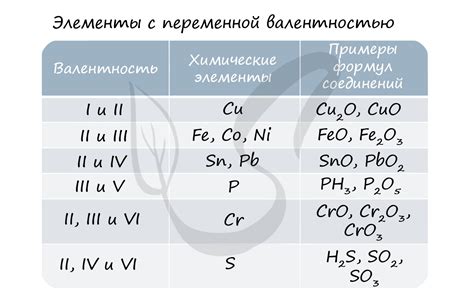
Азот обладает валентностью 4, что означает, что каждый атом азота образует 4 химические связи с другими атомами. Валентность 4 позволяет азоту образовывать различные химические соединения.
Степень окисления азота обозначает изменение заряда азотного атома в химическом соединении. Азот может иметь степень окисления 5, когда он связан с элементами, имеющими меньшую электроотрицательность, такими как водород (H) или бор (B).
Азот с валентностью 4 и степенью окисления 5 встречается в таких соединениях, как аммиак (NH3) и аммоний (NH4+). Аммиак содержит один атом азота, который образует 3 связи с водородом и имеет степень окисления 5. Аммоний представляет собой положительный ион, в котором один атом азота образует четыре связи с водородом и имеет степень окисления 5.
Азот с валентностью 4 и степенью окисления 5 играет важную роль в биологических и химических процессах. Например, аммоний является одной из форм азота, доступных растениям для поглощения из почвы и использования в процессе производства белка. Также аммоний используется в промышленности для производства удобрений и химических соединений.
- Азот с валентностью 4 и степенью окисления 5 образует важные соединения, такие как аммиак и аммоний.
- Валентность 4 позволяет азоту образовывать 4 химические связи.
- Степень окисления 5 обусловлена связью азота с элементами, имеющими меньшую электроотрицательность.
- Аммиак и аммоний играют важную роль в биологических и химических процессах.
Свойства азота

Азот является одним из самых распространенных элементов в атмосфере, составляя около 78% ее состава. В чистом виде азот представляет собой безцветный газ без запаха и вкуса.
Одно из основных свойств азота – его способность образовывать тройные связи с другими атомами. Благодаря этому азот может образовывать различные соединения, такие как аммиак (NH3), нитраты (NO3), амиды (NH2), и многие другие.
Важно отметить, что азот имеет валентность 4, что означает, что каждый атом азота может образовывать четыре связи с другими атомами. Это обусловлено наличием у атомера азота пяти электронов во внешней оболочке. Однако, в некоторых соединениях азот может иметь степень окисления 5, что делает его еще более реактивным.
Также азот является важным элементом для живых организмов. Он является частью аминокислот, которые являются строительными блоками белков, и является необходимым для синтеза ДНК и РНК.
Однако, азот может быть источником загрязнения окружающей среды. Выбросы азотных соединений, таких как оксиды азота, могут привести к формированию смога и кислотных дождей, которые негативно влияют на окружающую среду и здоровье человека.
Таким образом, свойства азота, такие как его способность образовывать различные соединения, его важность для жизни организмов и его потенциальное воздействие на окружающую среду, делают его одним из наиболее интересных и изучаемых элементов.
Валентность азота
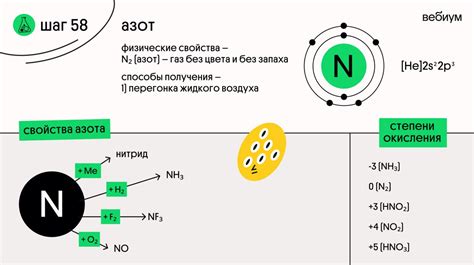
Наиболее распространенной валентностью азота является 3, что означает, что атом азота образует три ковалентные связи. В таком состоянии азот является неосноващим элементом, образует аммиак (NH3), гидразин (N2H4) и другие соединения.
Однако, под действием внешних факторов, азот может изменять валентность до 4 или 5. Валентность 4 соответствует образованию четырех ковалентных связей атома азота. Азот с валентностью 4 образует такие соединения, как оксид азота (N2O4), диоксид азота (NO2) и другие.
Валентность 5 азота соответствует образованию пяти ковалентных связей атома азота. В таком состоянии азот образует соединения, такие как нитраты (NO3-), нитриты (NO2-) и другие.
Валентность и степень окисления азота зависят от условий реакции и окружающей среды. Понимание этих величин позволяет более полно описывать процессы, в которых участвует азот, и предсказывать свойства соединений, в которых азот может находиться в различных валентностях.
Степень окисления азота
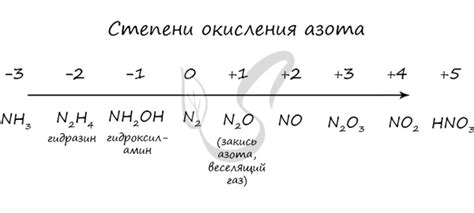
Азот обычно имеет степень окисления -3 в соединениях, таких как аммоний (NH4+) и азиды (N3-), где он присутствует в трехвалентном состоянии. Однако азот также может иметь степень окисления +3 в соединениях аммиака (NH3) и оксида азота (NO).
Наиболее интересной и редкой степенью окисления азота является +5, которая характерна для таких соединений, как азидные и нитрильные группы. Данные соединения образуются при присоединении атомов азота с уже существующими молекулами, при этом азоту необходимо дополнительное окисление, чтобы достичь степени окисления +5.
Степень окисления азота имеет большое значение при изучении его химических свойств и взаимодействий с другими элементами. Она позволяет предсказать и объяснить реактивность азота в различных соединениях и реакциях. Кроме того, степень окисления является важным параметром при назначении некоторых химических соединений в медицине и промышленности.
| Соединение | Степень окисления азота |
|---|---|
| NH4+ | -3 |
| N3- | -3 |
| NH3 | +3 |
| NO | +3 |
| азидные и нитрильные группы | +5 |
Азот как элемент питательности

Азот является частью аминокислот, которые являются строительными блоками белков – основных компонентов клеток. Белки отвечают за построение тканей, участвуют в обмене веществ, сигнальных каскадах и других процессах, необходимых для нормального функционирования растения.
Важным аспектом роли азота в питательности также является его влияние на способность растений фотосинтезировать. Азот является необходимым компонентом в составе хлорофилла – пигмента, отвечающего за поглощение энергии света. Без достаточного содержания азота в почве, растения могут испытывать недостаток хлорофилла и, следовательно, проблемы с фотосинтезом.
Кроме того, азот влияет на развитие корневой системы растений. Он стимулирует рост корней, увеличивает их массу и образование волосковых корневых ворсинок. Это особенно важно для растений, которые зависят от азота в первую очередь в начальной стадии развития, таких как семена и молодые растения.
Таким образом, азот является неотъемлемым элементом питательности для растений, необходимым для их нормального роста, развития и функционирования. Удовлетворение потребностей растений в азоте важно для достижения высоких урожаев и поддержания здоровья растений в садах и огородах.
Использование азота в производстве удобрений

Одним из наиболее распространенных и эффективных удобрений, содержащих азот, являются минеральные удобрения. Они производятся путем синтеза аммиака, получаемого из природного азота. Наиболее распространенными процессами для синтеза аммиака являются процесс Габера и процесс Оствальда.
Аммиак, полученный из природного азота, используется в составе азотных удобрений, таких как аммиачная селитра и аммонийные соли. Эти удобрения имеют степень окисления азота +5 и широко применяются для повышения урожайности и качества сельскохозяйственных культур.
Удобрения, содержащие азот, не только способствуют улучшению питательных веществ, но и повышают стойкость растений к болезням, а также улучшают их цветение и плодоношение. Азот является основным компонентом белка, поэтому его доступность в почве имеет решающее значение для растений.
Таким образом, использование азота в производстве удобрений играет важную роль в повышении урожайности и качества сельскохозяйственных культур, а также способствует повышению устойчивости растений к внешним воздействиям.
Важность азота в растительном и животном мире

Одной из основных функций азота в растительном мире является его участие в процессе фиксации атмосферного азота и его превращении в органические соединения. Растения поглощают азот в виде нитратов или аммония, которые используются для синтеза белков, нуклеиновых кислот и других важных молекул.
Азот также необходим для роста и развития корней растений. Он способствует образованию корневых волосков, которые усваивают воду и питательные вещества из почвы. Без достаточного количества азота, растения могут страдать от замедленного роста и недостатка питательных веществ.
В животном мире, азот является неотъемлемой частью белков, аминокислот и других жизненно важных молекул. Он участвует в образовании гемоглобина – красного пигмента в крови, который переносит кислород к клеткам организма. Азот также входит в состав нуклеиновых кислот, ответственных за передачу генетической информации.
Кроме того, азот играет важную роль в энергетическом обмене организма. Он присутствует в составе аденозинтрифосфата (АТФ), который является основным источником энергии для клеток.
В целом, азот играет ключевую роль в поддержании жизнедеятельности растений и животных, обеспечивая необходимое питание, рост и развитие организмов. Его наличие в почве и в организмах является фундаментальным для поддержания биологического равновесия и продуктивности экосистем.
Роль азота в химической промышленности

Одним из основных применений азота в химической промышленности является производство азотной кислоты. Азотная кислота широко используется в процессах синтеза различных органических и неорганических соединений, а также в производстве удобрений. Процесс получения азотной кислоты основан на реакции окисления аммиака, в которой азот играет важную роль в качестве источника кислорода.
Другим важным применением азота является использование его в процессах синтеза аммиака. Аммиак широко используется в производстве удобрений, пластмасс, красителей и других химических соединений. Процесс синтеза аммиака основан на реакции между азотом и водородом при высокой температуре и давлении. В данной реакции азот играет важную роль в качестве реагента.
Кроме того, азот используется в процессах обезвреживания отходов, очистки воды, предотвращения коррозии и других промышленных процессах. Азотную среду можно использовать для предотвращения окисления и снижения взрывоопасности в определенных процессах, а также для контроля окружающей среды и обеспечения безопасности в рабочих местах.
Таким образом, азот играет важную роль в химической промышленности, обеспечивая процессы синтеза, окисления и стабилизации различных химических соединений. Его высокая валентность и степень окисления позволяют использовать азот в различных химических реакциях, делая его неотъемлемой частью современной промышленности.
Взаимосвязь между валентностью и степенью окисления азота
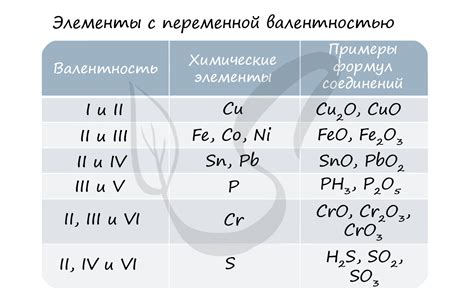
Валентность азота обусловлена его электронной конфигурацией, которая состоит из 7 электронов. Атом азота стремится достичь стабильной электронной конфигурации, заполнив свою валентную оболочку. Для этого атом азота может образовывать связи с другими атомами путем разделения или приобретения электронов. Таким образом, азот может проявлять валентность 4, образуя четыре ковалентные связи с другими атомами.
Степень окисления азота – это числовая характеристика, отражающая число электронов, которые атом азота переходит при образовании соединения. В соединениях со степенью окисления 5, атом азота теряет 5 электронов, чтобы достичь более стабильной электронной конфигурации. Примером такого соединения может служить нитратный ион (NO3-), где атом азота окисляется до +5.
Таким образом, валентность азота и его степень окисления связаны друг с другом и определяют способ взаимодействия атома азота с другими атомами и формирование соединений. При проявлении валентности 4 атом азота образует четыре ковалентные связи, а при степени окисления 5 атом азота теряет 5 электронов. Эти характеристики азота играют важную роль во многих химических реакциях и процессах.
Применение азота в медицине

Азот играет важную роль в медицине благодаря своим свойствам и способностям. Врачи применяют азот для проведения различных медицинских процедур.
Одним из наиболее известных применений азота является использование жидкого азота для криохирургии. Во время этой процедуры, врач применяет жидкий азот для замораживания тканей, что позволяет удалить опухоли и бороться с доброкачественными и злокачественными образованиями.
Азот также используется для создания кислородно-азотных смесей, которые применяются в анестезиологии для поддержания анестезии и облегчения дыхания пациентов. Кроме того, азот используется в других областях медицины, таких как криотерапия, гематология и кардиология.
Азот и его влияние на окружающую среду

Азот имеет несколько видов валентности, в том числе валентность 4 и степень окисления 5. Валентность 4 позволяет азоту образовывать четыре связи с другими атомами, что позволяет ему образовывать стабильные молекулы. Степень окисления 5 означает, что азот потерял пять электронов и является окислителем, способным принимать электроны от других веществ.
Одним из основных источников азота в атмосфере является промышленное производство и использование азотных удобрений. При неправильном использовании этих удобрений они могут попадать в водные системы и вызывать проблему эутрофикации – процесса, когда избыток азота способствует размножению водных растений, что может негативно сказываться на экосистеме: воды становятся мутными, водные организмы теряют свои места обитания, а появление водорослей может приводить к кислородному голоданию и гибели рыб.
Кроме того, азотные оксиды (вещества, в которых азот имеет степень окисления 5) являются сильными парниковыми газами, способными удерживать тепло в атмосфере земли и приводить к глобальному потеплению. Избыточное содержание этих газов в атмосфере может приводить к изменению климата и увеличению температуры на Земле.
Таким образом, использование азотных удобрений и производственные процессы, связанные с азотом, могут приводить к серьезным проблемам в окружающей среде. Для более устойчивого развития необходимо применять азотные удобрений в соответствии с экологическими стандартами и искать альтернативные способы обогащения почвы и получения азотных соединений, не наносящие вред окружающей среде.



