В химии активность металлов – это их способность проявлять активность в химических реакциях. При этом активность зависит от множества факторов, таких как электрохимический потенциал, электроотрицательность, реакционная способность и другие.
Одним из способов определения активности металлов является их положение в ряду электрохимических потенциалов. Следуя этому подходу, можно сказать, что кальций (Ca) и стронций (Sr) относятся к группе щелочноземельных металлов и обладают высокой степенью активности.
Однако, если сравнивать активность Ca и Sr между собой, то можно заметить, что кальций является более активным металлом по сравнению со стронцием. Это связано с различием в их строении атомов и электронной конфигурации.
Кальций (Ca) имеет атомный номер 20 и атомную массу 40. Атом Ca имеет электронную конфигурацию 2, 8, 8, 2, что означает наличие двух валентных электронов во внешней электронной оболочке. Это делает его более реакционоспособным и активным металлом.
С другой стороны, стронций (Sr) имеет атомный номер 38 и атомную массу 87. Атом Sr имеет электронную конфигурацию 2, 8, 18, 8, 2, что также означает наличие двух валентных электронов во внешней электронной оболочке. Однако, большая атомная масса делает его электроотрицательность меньше, что в свою очередь снижает активность металла.
Влияние молекулярной структуры на активность металлов

Одним из факторов, влияющих на активность металлов, является их атомный радиус. Чем больше атомный радиус металла, тем слабее он удерживает свои электроны во внешней электронной оболочке. В случае с кальцием и стронцием, атомный радиус стронция больше, чем у кальция. Это означает, что стронций имеет более слабую силу удержания своих внешних электронов, что делает его более активным металлом по сравнению с кальцием.
Кроме того, молекулярная структура металлов также может определять их активность. В случае с кальцием, его атомы образуют кристаллическую решетку с гранями, на которых находятся электроны. Это позволяет кальцию более эффективно вступать в реакцию с другими веществами. Стронций, в свою очередь, имеет более сложную молекулярную структуру, что может затруднять его взаимодействие с другими веществами, и, таким образом, снижать его активность.
| Металл | Атомный радиус (нм) | Молекулярная структура | Активность |
|---|---|---|---|
| Кальций (Ca) | 0.197 | Кристаллическая решетка | Более активный |
| Стронций (Sr) | 0.215 | Сложная | Менее активный |
Металлы: основные характеристики

Проводимость электричества: Металлы обладают высокой проводимостью электричества. Именно поэтому они широко используются в электронике и электротехнике.
Проводимость тепла: Металлы также обладают высокой проводимостью тепла. Это делает их идеальными материалами для производства нагревательных элементов и обогревателей.
Пластичность: Металлы могут быть легко расплавлены и переработаны. Они обладают высокой пластичностью, что позволяет формировать их в различные конструкции и изделия.
Прочность: Металлы обладают высокой прочностью, что делает их надежными материалами для строительства и производства механизмов.
Магнитные свойства: Некоторые металлы обладают магнитными свойствами, что делает их полезными в производстве магнитов и электромагнитов.
Ca и Sr - два металла, относящихся к группе щелочноземельных металлов. Оба металла обладают сходными химическими свойствами, но Ca является более активным из них. Это связано с тем, что внешняя электронная оболочка Ca содержит всего два электрона, в то время как Sr имеет четыре электрона в своей внешней оболочке. Большее количество электронов в оболочке Sr обеспечивает ему большую стабильность, что делает Ca более активным в химических реакциях.
Реакция металлов с водой

Кальций (Ca) является более активным металлом, чем стронций (Sr), и имеет более высокую реакционную способность с водой. При контакте с водой кальций образует гидроксид кальция (Ca(OH)2) и выделяет большое количество водорода (H2).
Стороной (Sr) также реагирует с водой, но его реакция протекает более медленно и менее интенсивно, чем у кальция. При реакции со стронцием образуется гидроксид стронция (Sr(OH)2) и выделяется небольшое количество водорода (H2).
Различия в реакционной активности кальция и стронция можно объяснить различием во внешней электронной структуре этих металлов. Кальций имеет два валентных электрона, а стронций - четыре. Большее количество валентных электронов в стронции приводит к увеличению радиуса атома и слаблению его электростатической силы взаимодействия с водой.
В целом, реакция металлов с водой зависит от их электрохимической активности и валентности. Кальций, обладая более высокой активностью и меньшим количеством валентных электронов, реагирует с водой более интенсивно, чем стронций.
Окислительная активность металлов

Потенциал окисления представляет собой меру того, насколько легко металл может отдать свои электроны. Чем выше потенциал окисления металла, тем более активным он является в окислительных реакциях.
В сравнении между Ca и Sr, можно сказать, что оба металла относятся к группе щелочноземельных элементов и обладают высокой окислительной активностью. Однако, по сравнению с Ca, Sr демонстрирует более высокий потенциал окисления.
Причина этой разницы в активности заключается в структуре атомов этих металлов. Атомы Ca имеют одну внешнюю электронную оболочку, которая легко отдается, поэтому Ca является активным окислителем. В то же время, атомы Sr имеют две внешние электронные оболочки, которые создают более высокий потенциал окисления, что делает Sr еще более активным окислителем.
Активность Ca и Sr в периодической таблице

Первое различие между Ca и Sr заключается в их атомных радиусах. Атомный радиус Sr немного больше, чем у Ca. Это связано с тем, что при переходе от Ca к Sr происходит увеличение числа электронных оболочек, что ведет к увеличению размеров атома. Более крупные размеры атома Sr позволяют ему проявлять большую активность в реакциях.
Второе различие связано с энергией ионизации. Ионизационная энергия - это энергия, необходимая для удаления электрона из атома. У Sr энергии ионизации меньше, чем у Ca. Это означает, что Sr способен легче отдавать электроны и образовывать положительные ионы, что делает его более активным по сравнению с Ca.
Также следует отметить, что активность металлов может зависеть от условий реакции. В некоторых условиях Ca может проявлять более высокую активность, чем Sr, например, в реакциях с водой. Однако, общая тенденция говорит о том, что Sr более активен, чем Ca.
В целом, можно сказать, что Sr является более активным металлом, чем Ca, благодаря его большему атомному радиусу и нижней энергии ионизации.
Активность Ca и Sr в химических реакциях
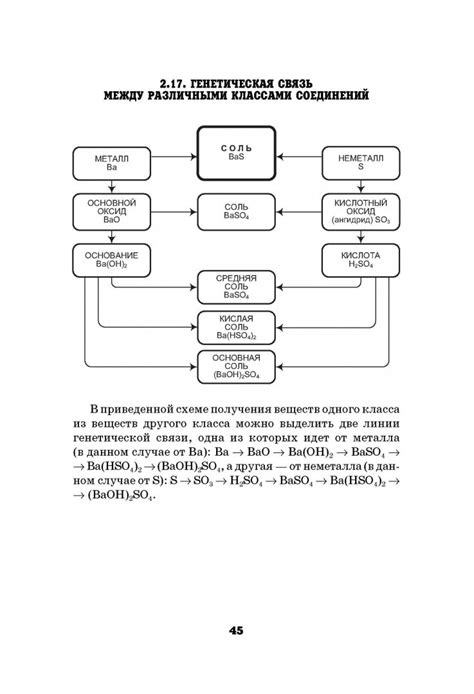
Основной фактор, определяющий активность металла, это его электронная структура. У этих двух элементов она сходна и оба металла имеют два электрона в валентной оболочке. Однако, у Sr электроны находятся на более высоком энергетическом уровне, что делает его более реактивным.
Еще одним фактором, влияющим на активность металла, является его радиус. Больший атомный радиус у Sr делает его электроны менее плотными и более легко доступными для реакций. Таким образом, Sr проявляет большую склонность к образованию химических связей и реакциям, чем Ca.
Активность металлов также проявляется при их реакции с водой. Ca и Sr оба реагируют с водой, образуя двуокиси металлов и выделяя водород. Однако, Sr реагирует с водой более интенсивно и быстро, чем Ca. Это еще одно подтверждение большей активности Sr.



