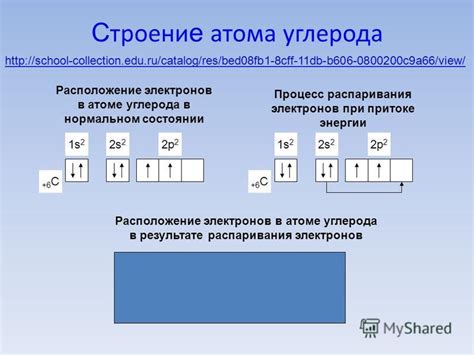
Атом углерода является основой для формирования огромного разнообразия органических соединений, которые играют важную роль в биологии, химии и технологии. Атом углерода имеет шесть электронов, распределенных по своим энергетическим оболочкам. В химических реакциях атом углерода может эмитировать или получать электроны, что приводит к изменению его химических свойств. Однако, особенным является распаривание 2s электронов.
Обычно атом углерода заполняет свою внешнюю оболочку, имеющую энергетический уровень 2s22p2, четырьмя электронами. Но при некоторых условиях, энергия 2s электронов может стать доступной для распаривания. Это происходит, если энергия стимула, каким может являться тепло, свет или электрическое поле, превышает энергию 2s электронов, позволяя им перейти на более высокий энергетический уровень.
Распаривание 2s электронов в атоме углерода является способом для атома осуществлять связи с другими атомами и образовывать химические соединения. Это процесс, который играет важную роль в формировании сложных структур углеродных соединений, таких как органические молекулы и полимеры. Знание о возможности распаривания 2s электронов позволяет контролировать и манипулировать химическими свойствами углерода и его соединений, что имеет большое значение для разработки новых материалов и технологий.
Механизм распаривания 2s электронов в атоме углерода
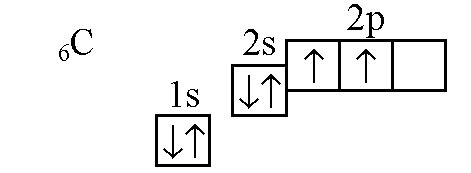
Распаривание 2s электронов в атоме углерода осуществляется через переход электрона с более высокого энергетического уровня на 2s орбиталь. В результате этого процесса, в атоме образуется два электрона на орбитале с однимакотоличество спинового момента.
Механизм распаривания 2s электронов в атоме углерода могут быть представлен в виде следующей таблицы:
| Электронный уровень | Количество электронов |
|---|---|
| 1s | 2 |
| 2s | 2 |
| 2p | 2 |
Как видно из таблицы, орбиталь 2s может содержать максимум два электрона. Однако, в процессе распаривания, электры исходно находящиеся на 2p орбитале переходят на 2s орбиталу, что приводит к формированию двух электронов с однимакотле индексом спина.
Таким образом, механизм распаривания 2s электронов в атоме углерода заключается в переходе электронов с более высокого энергетического уровня на 2s орбиталу. Это продолжает и обогащает наши знания о строении и свойствах атомов углерода, которые являются основой для понимания химического поведения и реакций этого элемента.
Атом углерода: электронная конфигурация и свойства
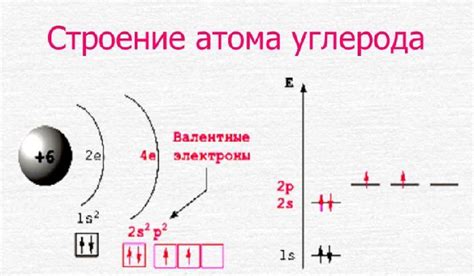
Электронная конфигурация атома углерода
Атом углерода имеет атомный номер 6, что означает, что у него в атоме находится 6 электронов. Схематически эти электроны обозначаются следующим образом:
1s2 2s2 2p2
Такая электронная конфигурация означает, что в основном состоянии атом углерода имеет два электрона в первой электронной оболочке (s-орбиталь) и четыре электрона во второй электронной оболочке (s- и p-орбитали).
Свойства атома углерода
Атом углерода является уникальным и имеет множество особенностей, которые делают его незаменимым элементом в органической химии:
1. Тетраэдральная структура: Атом углерода способен образовывать четыре химических связи с другими атомами углерода или другими элементами. Это позволяет ему образовывать гибкие и стабильные структуры, что делает углерод основой всех органических соединений.
2. Образование двойных и тройных связей: Атом углерода может образовывать двойные и тройные связи с другими атомами углерода или с атомами других элементов. Это способствует образованию различных классов органических соединений, таких как алкены и алкины.
3. Полимеризация: Атомы углерода могут образовывать длинные цепочки, называемые полимерами, путем связывания между собой множества маленьких молекул. Это позволяет образовывать различные материалы, такие как пластик и резина.
4. Способность образовывать химические соединения: Углерод обладает способностью образовывать различные химические соединения с другими элементами, такими как водород, кислород и азот. Это делает углерод основным строительным элементом многих органических соединений, включая белки, углеводы и жиры.
Атом углерода играет ключевую роль в органической химии и жизненных процессах, и его свойства позволяют ему образовывать огромное количество разнообразных соединений.
Энергетические уровни электронов в атоме углерода

Атом углерода, как и другие атомы, содержит энергетические уровни, на которых располагаются его электроны. Изучение этих уровней позволяет понять, как происходит распределение электронов в атоме углерода и каким образом может возникнуть явление распаривания 2s электронов.
Энергетические уровни электронов представляют собой различные значения энергии, на которых может находиться электрон. В атоме углерода существуют несколько уровней энергии, которые обычно обозначаются буквами K, L, M, N и т.д. Каждый уровень энергии может содержать определенное количество электронов.
Наиболее низкий энергетический уровень атома углерода - уровень K. Он может содержать не более 2 электронов. На следующем уровне энергии - уровне L, может находиться до 8 электронов. На уровне M - до 18 электронов, на уровне N - до 32 электронов и так далее.
Ключевым фактором, определяющим распределение электронов в атоме углерода, является принцип заполнения электронных оболочек. Согласно этому принципу, наиболее низкий энергетический уровень заполняется в первую очередь, а затем уже заполняются следующие уровни в порядке их возрастания энергии.
Таким образом, у атома углерода электроны вначале заполняют уровень K, на котором могут находиться только 2 электрона. Затем, на уровне L, которому соответствует электронная оболочка 2s, могут находиться до 8 электронов.
Распаривание 2s электронов в атоме углерода возможно из-за того, что на данном уровне энергии может находиться максимум 8 электронов. При наличии большего количества электронов на этом уровне, некоторые из них начинают "распариваться" и занимать другие более высокие уровни энергии, такие как уровни M, N и т.д.
Энергетические уровни электронов и их распределение в атоме углерода являются ключевыми понятиями для понимания его химических свойств и возможности образования различных соединений.
Следствия распаривания 2s электронов в атоме углерода
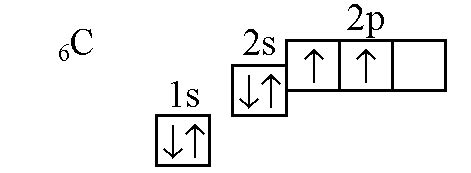
Распаривание 2s электронов в атоме углерода приводит к значительным последствиям, которые оказывают существенное влияние на химические свойства углерода и его соединений.
1. Образование двухнеорганических соединений: Распаривание 2s электронов в атоме углерода создает два одиночных электрона в п-орбитали, что позволяет углероду образовывать двухнеорганические соединения. Такие соединения могут быть связаны с другими атомами углерода, образуя длинные цепочки или кольца, что приводит к разнообразию органических соединений.
2. Способность образовывать ковалентные связи: Распаривание 2s электронов в атоме углерода увеличивает его способность образовывать ковалентные связи с другими атомами. Углерод обладает четырьмя валентными электронами, что позволяет ему образовывать до четырех ковалентных связей с другими атомами углерода или с другими атомами элементов, такими как водород, кислород, азот и др.
3. Разнообразие органических соединений: Распаривание 2s электронов в атоме углерода способствует образованию разнообразных органических соединений, которые являются основой для построения множества биологических молекул и материалов, таких как пластик, лекарственные препараты, каучук и многое другое.
4. Полиморфизм и аллотропия углерода: Распаривание 2s электронов в атоме углерода влияет на его структурные свойства, что приводит к возникновению полиморфизма и аллотропии. Углерод может существовать в различных формах, таких как алмаз, графит, фуллерены и нанотрубки, каждая из которых обладает уникальными физическими и химическими свойствами.
Роль распаривания 2s электронов в химических реакциях углерода
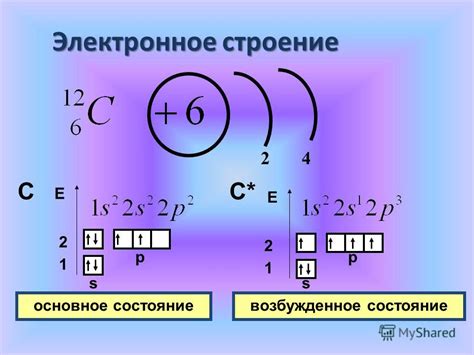
Одним из ключевых свойств электронной структуры углерода является существование двух электронов в 2s орбитали. Однако, во многих химических реакциях углерода, эти электроны распариваются, что оказывает значительное влияние на химическую активность и реакционную способность этого элемента.
Распаривание 2s электронов углерода происходит в процессе образования химических связей и обеспечивает возможность образования множества разнообразных органических соединений. Распаривание 2s электронов приводит к возникновению двух пустых п орбиталей, что делает углерод способным к образованию координационной связи с другими атомами.
Это является основой для образования множества химических соединений углерода, таких как углеводороды, аминокислоты, жиры, углеродные кислоты и другие. Распаривание 2s электронов углерода также позволяет ему образовывать двойные и тройные связи, что делает его одним из самых реакционноспособных элементов.
Важно отметить, что распаривание 2s электронов углерода происходит не только при образовании связей, но и при реакциях разрыва связей. Это позволяет углероду легко участвовать в различных химических превращениях и обеспечивает его высокую химическую активность.
Таким образом, распаривание 2s электронов в атоме углерода играет ключевую роль в его химической активности и реакционной способности, позволяя образовывать множество разнообразных органических соединений и участвовать в различных химических превращениях.
Практическое применение распаривания 2s электронов в атоме углерода
Распаривание 2s электронов в атоме углерода имеет важное практическое применение в различных областях науки и технологии. Ниже приведены некоторые из них:
- Синтез органических соединений: распаривание 2s электронов позволяет углероду образовывать 4 связи с другими атомами, что является основой для синтеза огромного количества органических соединений. Благодаря этому углерод является основным элементом живой материи и является основой органической химии.
- Производство материалов и топлива: распаривание 2s электронов позволяет углероду образовывать различные структуры, такие как алмаз и графит, которые имеют различные свойства и могут использоваться для создания разнообразных материалов и топлива.
- Электроника: распаривание 2s электронов в атоме углерода позволяет создавать различные виды полупроводников, таких как графен и углеродные нанотрубки, которые могут быть использованы в электронике, такой как транзисторы и солнечные батареи.
- Катализ: углеродные материалы, полученные из распаривания 2s электронов, могут быть использованы в качестве катализаторов для различных химических реакций, таких как производство пластиков и фармацевтических препаратов.
Это лишь некоторые примеры практического применения распаривания 2s электронов в атоме углерода. Понимание этого процесса играет важную роль в развитии различных отраслей науки и технологии.



