Созерцание жировой капли на поверхности воды часто вызывает у нас восхищение своей непроницаемостью: вода кажется неспособной перебороть силы взаимодействия между молекулами жира и объять его себе, однако, это лишь иллюзия. Вода неспособна смачивать жир не из-за своей слабости, а из-за особого строения и взаимодействия молекул этих двух веществ в микромире.
Основной физической причиной, почему вода не смачивает жир, является отличие в их поверхностных свойствах. Водные молекулы образуют своего рода "сетку" на поверхности жидкости, из-за взаимодействия между отдельными молекулами воды. Эта сетка обладает высокой силой сцепления и стабильностью, что препятствует проникновению молекул жира.
Жир же в свою очередь, состоит из молекул, имеющих гидрофобные свойства - они не способны вступать во взаимодействие с молекулами воды и, наоборот, стремятся к объединению с другими молекулами жира. Это вызывает образование «столбика» капли жира на поверхности воды, которую нельзя смочить.
Вода и жир: почему вода не смачивает жир?
Вода - это полярное соединение, что означает, что молекулы воды имеют положительно заряженные и отрицательно заряженные концы. Наоборот, жир - это неполярное вещество, его молекулы не имеют положительно и отрицательно заряженных концов.
Это приводит к тому, что вода не взаимодействует с жиром так, как она делает это с другими полярными веществами. Когда капля воды попадает на поверхность жира, вода не может проникнуть внутрь жира и размещается на его поверхности. Это объясняется тем, что силы взаимодействия между молекулами воды и жира слабы и не способны преодолеть силы притяжения молекул жира.
Кроме того, жир имеет низкую поверхностную энергию, то есть молекулы жира слабо притягивают друг друга. Это также способствует образованию капель воды на поверхности жира, вместо того, чтобы проникать внутрь него.
Таким образом, вода и жир не смешиваются из-за разницы в их физических свойствах, таких как полярность и поверхностная энергия. Невозможность смачивания водой жира объясняет, почему они не смешиваются в природе и почему вода не способна эффективно очищать поверхности, покрытые жиром.
Сила поверхностного натяжения
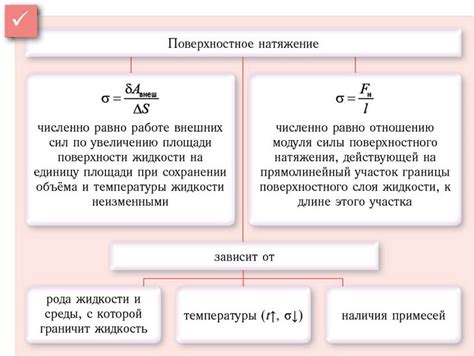
Вода не смачивает жир из-за своего высокого поверхностного натяжения. Поверхность воды стремится сократить площадь, чтобы уменьшить поверхностную энергию. Из-за этого вода образует "капельки", которые остаются на поверхности, не сливаясь с жиром.
Поверхностное натяжение возникает из-за сил межмолекулярного притяжения молекул воды друг к другу. Молекулы, находящиеся на поверхности, испытывают дополнительную силу притяжения со стороны соседних молекул, что делает поверхность воды более упругой и препятствует проникновению жидкости.
Таким образом, сила поверхностного натяжения объясняет, почему вода не смачивает жир и образует капельки на его поверхности.
Молекулярная структура воды
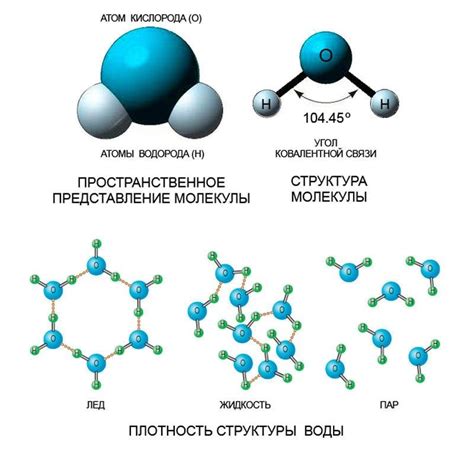
Молекула воды состоит из двух атомов водорода и одного атома кислорода, соединенных ковалентными связями. Угловое расположение атомов придает молекуле воды две пары несвязанных электронных пары валентной оболочки кислорода. Это приводит к появлению полярности в молекуле воды.
Полярность молекулы воды обусловлена разницей в электроотрицательности атомов кислорода и водорода. Атомы кислорода сильнее притягивают электроны, что приводит к неравномерному распределению зарядов в молекуле. В результате, на электронно обедненном кислороде образуется отрицательный заряд, а на электронно обогащенных атомах водорода - положительный заряд.
Электростатические силы притяжения между положительно заряженными атомами водорода одной молекулы и отрицательно заряженным атомом кислорода другой молекулы воды называются водородными связями. Водородные связи обладают значительной прочностью и играют важную роль в устойчивости и физических свойствах воды.
| Свойство | Значение |
|---|---|
| Высокая температура кипения и плавления | Водородные связи требуют большого количества энергии для разорвания |
| Высокая теплоемкость | Водородные связи поглощают и отдают большое количество тепла |
| Повышенная плотность льда | Вода при замерзании образует решетку из водородных связей, что приводит к возникновению пустот между молекулами и увеличивает объем |
| Высокое поверхностное натяжение | Водородные связи образуют сильные связи между молекулами, что способствует образованию пленки на поверхности воды |
| Низкая вязкость | Водородные связи позволяют молекулам воды легко скользить друг по другу |
Из-за полярности молекулы воды, она образует водородные связи с другими полярными молекулами, такими как алкоголи или другие вещества с положительными и отрицательными зарядами. Однако, жир является неполярным веществом, у которого нет зарядов. Поэтому, водородные связи между молекулами воды и молекулами жира не образуются, и вода не может смачивать жир.
Совместимость гидрофильных и гидрофобных веществ
Гидрофильные и гидрофобные вещества обладают совершенно разными свойствами взаимодействия с водой. Гидрофильные вещества, такие как соль или сахар, способны растворяться в воде и образовывать с ней гомогенные смеси. Это происходит благодаря их способности образовывать водородные связи или обладать полярными молекулярными группами, которые способны взаимодействовать с полярными молекулами воды.
Гидрофобные вещества, наоборот, не растворяются в воде и образуют с ней несмешивающиеся фазы. Примерами гидрофобных веществ могут служить жиры, масла или пластиковые материалы. Гидрофобные вещества обладают низкой полярностью и не могут взаимодействовать с полярными молекулами воды. Вода же, будучи полидипольной молекулой, образует взаимодействия между собой, образуя водородные связи, что делает ее гидрофильной.
Вода и гидрофобные вещества реагируют между собой по принципу "вода не смачивает жир". Это можно увидеть на примере капель воды, которые на поверхности гидрофобного вещества (например, листьев растений или пластикового предмета) скатываются в шарики. Это связано с тем, что вода стремится минимизировать свою поверхностную энергию и образовывать как можно меньше контактной площади с гидрофобными веществами.
Совместимость гидрофильных и гидрофобных веществ важна не только для понимания физических свойств веществ, но и имеет практическое применение в многих областях, таких как фармакология, биология и химия материалов.
Физические свойства жира

Жир обладает рядом физических свойств, которые делают его нерастворимым в воде и неспособным к смачиванию:
- Гидрофобность: Молекулы жира имеют гидрофобные участки, которые не притягивают к себе молекулы воды. Это свойство является результатом наличия в жире гидрофильных групп, которые отталкивают воду.
- Молекулярное строение: Жирные кислоты в молекуле жира связаны с глицерином через ковалентные связи. Это делает молекулу жира большой и неоднородной, что затрудняет проникновение воды внутрь молекулы.
- Отсутствие полярности: Молекулы жира не имеют полярных групп, которые могут образовывать водородные связи с молекулами воды. Полярность играет ключевую роль в способности вещества смачивать воду.
В результате этих физических свойств жира, он отталкивает воду и не способен смачивать ее. Это объясняет, почему жирные пятна на одежде не удаляются простым промыванием в воде и требуют использования моющих средств или растворителей, которые способны разрушить структуру жира и удалить его.
Движение молекул при смачивании
При контакте воды с жиром, молекулы воды стремятся сформировать связи с дружественными молекулами воды, образуя так называемые водородные связи. Однако, жирные молекулы не обладают полярностью и не могут участвовать в образовании таких связей.
В результате этого различия в свойствах молекул, вода не может проникать в структуру жира и смачивать его. Вместо этого, вода формирует капли на поверхности жира.
Это явление можно наблюдать, например, когда наливают воду в стеклянный стакан с оливковым маслом. Вода будет скапливаться на поверхности масла и не смешиваться с ним.
Вода и жир в быту и в науке

В быту, мы наблюдаем, как вода и жир не смешиваются между собой. Например, когда мы моем посуду, мы пользуемся моющим средством для удаления жира. Обычно мы добавляем моющее средство в воду, чтобы разрушить и удалить жирные пятна. Это происходит потому, что жир не растворим в воде и не способен смачивать ее.
В науке, это свойство взаимодействия воды и жира объясняется различием в полярности молекул. Вода - полярное вещество, которое образует водородные связи между своими молекулами. В то же время, жир - неполярное вещество, молекулы которого не содержат полярных связей. Именно это различие в полярности делает жир несмачиваемым водой.
Таким образом, вода и жир представляют собой пример взаимодействия между двумя основными классами веществ - полярными и неполярными соответственно. Понимание этого взаимодействия помогает нам не только в быту, но и в научных исследованиях, где вода и жир играют важную роль.



