Аммиак – одно из наиболее распространенных соединений в химической промышленности, и он широко используется в разных областях науки и техники. Его комплекс с хлоридом серебра и нитратом серебра, обозначаемый как Ag NH3 2 Cl HNO3, является одним из наиболее интересных соединений для исследования.
Однако, несмотря на свою значимость, Ag NH3 2 Cl HNO3 может легко разрушаться под воздействием различных факторов. Одной из главных причин разрушения является взаимодействие комплекса с окружающей средой.
Факторы окружающей среды, такие как температура, давление и pH-уровень, оказывают значительное влияние на стабильность Ag NH3 2 Cl HNO3. Изменение этих параметров может приводить к изменению свойств комплекса и даже его полному разрушению. Кроме того, взаимодействие с другими химическими соединениями также может привести к разрушению комплекса.
Другой важной причиной разрушения Ag NH3 2 Cl HNO3 является воздействие света. Ультрафиолетовые лучи могут вызывать фотохимические реакции в комплексе, что приводит к его разложению. Поэтому, для сохранения стабильности комплекса необходимо избегать прямого солнечного света, а также использовать меры предосторожности при его хранении и транспортировке.
Причины разрушения комплекса Ag NH3 2 Cl HNO3
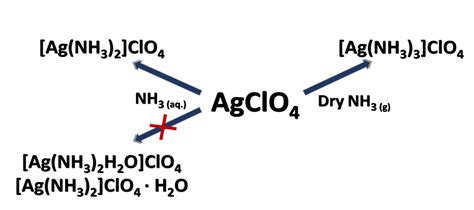
1. Взаимодействие с окружающей средой:
Комплекс Ag NH3 2 Cl HNO3 может подвергаться разрушению при взаимодействии с различными веществами в окружающей среде. Например, воздействие влаги или кислотных растворов может вызывать гидролиз комплекса, что приводит к разложению его структуры.
2. Действие высоких температур:
Высокие температуры также могут привести к разрушению комплекса Ag NH3 2 Cl HNO3. При нагревании комплекс может диссоциировать или выделять газы, что приводит к нарушению его структуры и разложению.
3. Взаимодействие с другими химическими соединениями:
Комплекс Ag NH3 2 Cl HNO3 может разрушаться при взаимодействии с другими химическими соединениями. Например, реакция комплекса с окислителями может привести к его окислению и разложению.
4. Длительное хранение:
Длительное хранение комплекса Ag NH3 2 Cl HNO3 в неправильных условиях может также вызвать его разрушение. Воздействие света, влажности или изменение pH среды, в которой хранится комплекс, может привести к изменению его структуры и разложению.
5. Взаимодействие с ионами металлов:
Взаимодействие комплекса Ag NH3 2 Cl HNO3 с ионами металлов может привести к его разрушению. Например, образование комплекса с ионами Cu2+ может привести к выделению осадка и разложению комплекса Ag NH3 2 Cl HNO3.
Все эти причины могут привести к разрушению комплекса Ag NH3 2 Cl HNO3 и, следовательно, изменению его свойств и реакционной активности.
Пероксидная окисление аммиака

В результате пероксидного окисления аммиака в комплексе Ag NH3 2 Cl HNO3 происходят химические изменения, которые могут привести к разрушению комплекса. Пероксидные соединения имеют сильную окислительную активность, поэтому они могут окислять металлы и их соединения. В данном случае, пероксиды приводят к окислению аммиака, что может привести к образованию других соединений в растворе и изменению структуры комплекса.
Таким образом, пероксидное окисление аммиака является важным фактором, способным разрушить комплекс Ag NH3 2 Cl HNO3 и привести к изменению его свойств и структуры.
Действие агрессивной среды

AgNH32ClHNO3 при взаимодействии с агрессивной средой, такой как концентрированная азотная кислота (HNO3), может разрушаться. Это связано с различными факторами, которые воздействуют на комплекс и приводят к его дезинтеграции.
В первую очередь, азотная кислота является сильным окислителем. Она может окислять агрегатное состояние аммиака, аммиачных соединений и ионов аммония в комплексе. Такое окисление может изменить структуру и свойства комплекса, что в конечном итоге приведет к его разрушению.
Другой фактор, способствующий разрушению комплекса, - это образование реакционных продуктов, таких как оксиды азота. Оксиды азота воздействуют на металлические ионные центры комплекса и способны привести к их дезактивации или нерегулярной реактивности.
Кроме того, агрессивная среда может способствовать образованию других окислительных или реакционных продуктов, которые могут реагировать с атомами серебра или другими компонентами комплекса, изменяя его свойства и структуру.
Все эти факторы в совокупности способствуют разрушению комплекса AgNH32ClHNO3 в агрессивной среде, что делает его непригодным для использования в таких условиях.
Реакция соляной кислоты с серебром
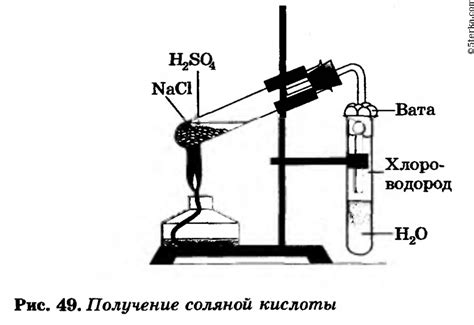
Реакция начинается с растворения соляной кислоты (HCl) в воде, где HCl диссоциирует, образуя ионы: H+ и Cl-. Серебро в виде иона Ag+ также является растворимым в воде.
После смешивания HCl и серебра, произойдет реакция ионов Ag+ с ионами Cl-, образующая хлорид серебра (AgCl). Эта реакция сопровождается осадком, который можно увидеть как белый осадок.
Таким образом, в результате реакции соляной кислоты с серебром будет образован осадок хлорида серебра (AgCl), что приведет к разрушению комплекса Ag NH3 2 Cl HNO3.
Важно отметить, что реакция соляной кислоты с серебром является одним из многих возможных разрушающих факторов для данного комплекса и зависит от конкретных условий, таких как pH, концентрация реагентов и окружающая среда.
Взаимодействие азотной кислоты с комплексом
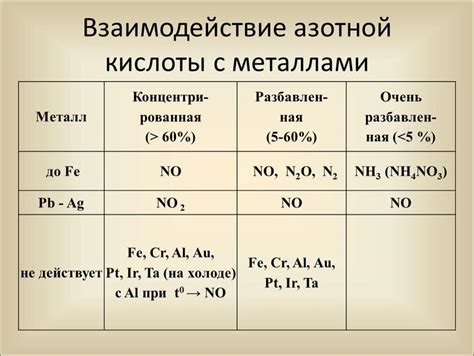
Азотная кислота (HNO3) представляет собой сильную окислительную кислоту, которая может взаимодействовать с аммиачным комплексом Ag(NH3)2Cl и вызвать разрушение структуры комплекса.
В результате взаимодействия азотной кислоты с комплексом происходит образование новых химических соединений и изменение их состава. При добавлении азотной кислоты к комплексу происходит реакция замещения, в результате которой аммиачные лиганды замещаются новыми анионами и катионами, образуя новые соединения.
Разрушение комплекса Ag(NH3)2Cl происходит в результате образования AgNO3 и других продуктов реакции. Возможными продуктами реакции могут быть AgCl, NH4Cl и другие соединения.
Взаимодействие азотной кислоты с комплексом Ag(NH3)2Cl является необратимым процессом, и разрушение комплекса не может быть перевернуто. Химическая реакция между азотной кислотой и комплексом может происходить при комнатной температуре и обычных условиях.
| Исходные реагенты | Продукты реакции |
|---|---|
| Ag(NH3)2Cl + HNO3 | AgNO3 + HCl + NH4Cl |



