Температура кипения является одной из важнейших характеристик любой жидкости. Она обозначает ту температуру, при которой жидкость начинает переходить в парообразное состояние. Но почему температура кипения жидкостей такая же?
Ответ на этот вопрос связан с физическими свойствами и структурой всех жидкостей. В основе температуры кипения лежит процесс испарения – переход молекул жидкости в газообразное состояние. При поднятии температуры жидкости увеличивается кинетическая энергия молекул, они начинают двигаться более активно и моментально преодолевают привлекательные силы других молекул.
Однако каждая жидкость имеет уникальную структуру. Некоторые молекулы связаны между собой слабыми химическими связями, которые влияют на силы притяжения между ними, в том числе и в жидком состоянии. Именно эти силы притяжения определяют температуру кипения – чем сильнее притяжение между молекулами, тем выше температура, необходимая для их перехода в газообразное состояние.
Почему жидкости имеют одинаковую температуру кипения?

Подобное явление объясняется свойствами молекул вещества. Кипение происходит, когда давление насыщенного пара нарушается и превышает внешнее давление. Молекулы жидкости при нагревании получают большую энергию и начинают двигаться быстрее. Когда их скорость достигает определенного уровня, они переходят в газообразное состояние.
Температура кипения зависит от межмолекулярных сил, которые действуют в веществе. Межмолекулярные силы могут быть различной природы, такой как водородные связи, ван-дер-ваальсовы силы и др. Если молекулы жидкости обладают схожими химическими свойствами и строением, то их межмолекулярные силы будут схожими. Это приводит к похожей энергии, необходимой для перехода жидкости в газообразное состояние, и соответственно, к схожей температуре кипения.
Например, у ряда органических растворителей, таких как этиловый спирт и метанол, температура кипения составляет около 78 градусов Цельсия. Это связано с наличием в молекулах этих растворителей схожих функциональных групп, таких как гидроксильная (-OH).
Таким образом, общая температура кипения определенной группы жидкостей объясняется их схожими межмолекулярными силами и структурой молекул. Это явление имеет практическое значение при различных процессах, связанных с нагреванием и кипением жидкостей.
Межмолекулярные силы влияют на параметры плавления

Одним из основных факторов, влияющих на температуру кипения, являются межмолекулярные силы. Эти силы возникают между молекулами вещества и имеют различную природу.
В заряженных молекулах, таких как молекулы воды, межмолекулярные силы проявляются в виде водородных связей. Водородные связи - это электростатические силы, возникающие между положительно заряженным водородом и отрицательно заряженным атомом кислорода. Эти силы довольно сильные и требуют большого количества энергии для преодоления, поэтому температура кипения воды высока.
В органических соединениях, таких как этанол, межмолекулярные силы проявляются в форме ван-дер-ваальсовых сил. Эти силы возникают благодаря взаимодействию неполярных молекул и вызывают появление временных диполей. Ван-дер-ваальсовы силы слабее, чем водородные связи, поэтому температура кипения этанола ниже.
Межмолекулярные силы влияют не только на температуру кипения, но и на другие параметры плавления, такие как температура плавления, вязкость и поверхностное натяжение. Понимание межмолекулярных сил позволяет лучше понять свойства различных жидкостей и их поведение.
Молекулярная структура: размеры и формы молекул
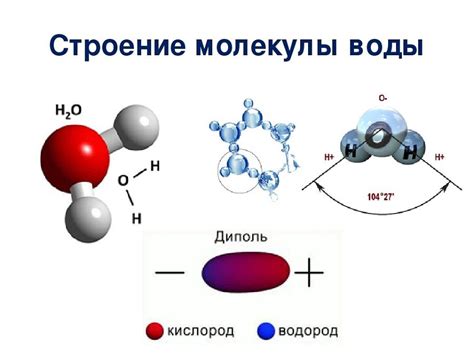
Молекулы, из которых состоят жидкости, имеют различные размеры и формы. Размеры и формы молекул определяются структурой и связями между атомами в молекуле.
Молекулы могут быть разных размеров - от небольших, состоящих из нескольких атомов, до огромных, содержащих сотни и тысячи атомов. Размеры молекул влияют на их физические свойства, такие как температура кипения.
Форма молекулы также играет важную роль. Молекулы могут быть линейными, кольцевыми или иметь сложную трехмерную структуру. Форма молекулы влияет на межмолекулярные взаимодействия и свойства жидкости в целом.
| Тип молекулы | Размер | Форма |
|---|---|---|
| Простые атомы | Маленький | Сферическая |
| Двухатомные молекулы | Маленький | Линейная или угловатая |
| Многоатомные молекулы | Средний или большой | Линейная, кольцевая или трехмерная |
Более сложные структуры молекул могут иметь симметрию или асимметрию, что также влияет на их свойства. Асимметричные молекулы могут обладать дипольным моментом, что приводит к более сильным межмолекулярным силам и высокой температуре кипения.
Таким образом, размеры и формы молекул являются важными факторами, определяющими температуру кипения жидкостей. Эти характеристики молекулярной структуры влияют на межмолекулярные взаимодействия и степень сил притяжения между молекулами, что определяет энергию, необходимую для преодоления сил притяжения и перехода в газообразное состояние.
Связанные с внешним давлением переменные

Когда внешнее давление выше атмосферного, то есть в условиях повышенного давления, молекулы жидкости испаряются менее сильно и требуют большего количества энергии, чтобы выйти на поверхность жидкости и образовать пар. Поэтому, в условиях повышенного давления, для достижения кипения жидкости требуется повышение температуры.
С другой стороны, когда внешнее давление ниже атмосферного, молекулы жидкости испаряются более интенсивно и требуют меньшего количества энергии, чтобы перейти из жидкого состояния в газообразное. Поэтому, в условиях пониженного давления, жидкость будет кипеть при более низкой температуре.
Существуют также исключения, когда связь между давлением и температурой кипения не так явная. Например, при некоторых условиях высокого давления, некоторые жидкости могут образовывать очень плотные структуры, которые затрудняют испарение и повышают температуру кипения.
В целом, знание связи между внешним давлением и температурой кипения позволяет эффективно контролировать процессы кипения и конденсации жидкостей в различных условиях и применениях.
Схожие структуры жидкостей и их взаимодействия
Структура и взаимодействия воды могут служить хорошим примером. Вода состоит из молекул, каждая из которых состоит из двух атомов водорода и одного атома кислорода. Эти молекулы, в свою очередь, могут образовывать водородные связи между собой. В результате таких связей вода образует сетчатую структуру, которая придает ей свои особые свойства, включая высокую температуру кипения.
Подобные сетчатые структуры и взаимодействия можно наблюдать и в других жидкостях. Например, молекулы метанола образуют водородные связи и образуют сетку, благодаря чему эта жидкость имеет более высокую температуру кипения по сравнению с другими алканолами.
Взаимодействие между молекулами жидкостей может определяться и другими силами, такими как ван-дер-Ваальсовы взаимодействия или ионные связи. Однако, независимо от конкретных взаимодействий, общая структура жидкости и взаимодействия между ее молекулами обуславливают температуру кипения.
Важно отметить, что хотя структуры и взаимодействия молекул различных жидкостей могут быть схожими, сами температуры кипения могут существенно различаться. Это обусловлено разными типами молекул и различиями во взаимодействиях между ними.
Эффект исключения растворителя

Когда такое вещество добавляется в раствор, оно между собой образует частицы, называемые агрегатами. Эти агрегаты рассеиваются в растворе и занимают некоторое пространство. В результате этого, между молекулами растворителя остается меньше места для движения, что вызывает повышение его температуры кипения.
Эффект исключения растворителя можно проиллюстрировать следующей таблицей:
| Растворитель | Нерастворимое вещество | Температура кипения (°C) |
|---|---|---|
| Вода | Соль | 100 |
| Вода | Сахар | 100 |
| Вода | Бензол | 80 |
| Этиловый спирт | Соль | 78 |
| Этиловый спирт | Сахар | 78 |
| Этиловый спирт | Бензол | 69 |
Как видно из таблицы, температура кипения воды и этилового спирта при наличии нерастворимого вещества (соли, сахара или бензола) остается примерно одинаковой. Это связано с тем, что нерастворимые вещества, не взаимодействуя с растворителем, не влияют на его свойства, в том числе и температуру кипения. Однако, добавление более плотного вещества, такого как бензол, может немного снизить температуру кипения растворителя.
Металлические жидкости: особенности кипения
Когда говорят о кипении жидкостей, обычно в первую очередь вспоминают воду или другие органические соединения. Однако, металлические жидкости также способны кипеть, но с некоторыми особенностями.
Во-первых, температура кипения металлических жидкостей обычно гораздо выше, чем у неорганических или органических соединений. Например, температура кипения жидкого железа составляет около 2861 °C, что существенно выше температуры кипения воды (100 °C). Это связано с особенностями химической связи в металлах, которая обладает гораздо более сильными внутренними силами.
Во-вторых, при кипении металлических жидкостей происходит целый ряд физических и химических переходов. В отличие от воды, которая просто испаряется при достижении определенной температуры, металлические жидкости претерпевают многофазные превращения. Например, при кипении жидкого железа происходит выделение газов, окисление и образование твердых фаз, что делает процесс кипения гораздо более сложным.
В-третьих, металлические жидкости имеют высокую теплопроводность, что обусловлено наличием металлической структуры. Это означает, что процесс кипения металлических жидкостей происходит гораздо быстрее, по сравнению с обычными жидкостями. Также, металлические жидкости могут кипеть при значительно более высоких давлениях, чем неорганические или органические соединения.
Таким образом, металлические жидкости обладают своими особенностями кипения, которые отличаются от кипения обычных жидкостей. Изучение этих особенностей имеет большое значение для различных технологических процессов и промышленности.
Влияние состава и примесей на температуру кипения
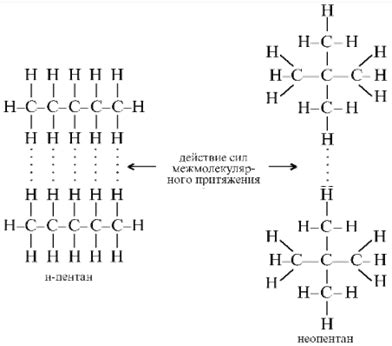
Температура кипения жидкости зависит от ее химического состава и наличия примесей. Разные химические вещества обладают различными молекулярными свойствами, которые влияют на их термодинамические характеристики. Это важно учитывать при изучении явления кипения и его основных параметров.
Одним из факторов, влияющих на температуру кипения, является молекулярная масса вещества. Жидкости с более высокой молекулярной массой имеют обычно более высокую температуру кипения. Это объясняется тем, что более массивные молекулы обладают большей инерцией и нуждаются в большей энергии для перехода из жидкого состояния в газообразное.
Кроме молекулярной массы, также важным фактором является силы взаимодействия между молекулами. Если молекулы вещества обладают сильными межмолекулярными силами, то их температура кипения будет выше. Это видно, например, на примере воды и спирта. Вода имеет более высокую температуру кипения, чем спирт, потому что межмолекулярные взаимодействия в воде значительно сильнее, благодаря водородным связям.
Примеси также оказывают существенное влияние на температуру кипения. Наличие даже незначительного количества примесей может снижать или повышать температуру кипения. Например, соль, растворенная в воде, повышает ее температуру кипения. Это происходит из-за того, что примесь нарушает силы взаимодействия между молекулами воды и требуется больше энергии для перехода из жидкого состояния в газообразное.
Таким образом, состав и примеси вещества существенно влияют на температуру его кипения. Это явление объясняется химическими и физическими свойствами молекул, а также их взаимодействием друг с другом. Понимание этого процесса позволяет более точно прогнозировать и контролировать температуру кипения жидкостей в различных условиях и при наличии различных примесей.
Температура кипения: закон Вант-Гоффа

Закон Вант-Гоффа, разработанный голландским химиком Якобом Вант-Гоффом в 1884 году, устанавливает связь между температурой кипения и давлением жидкости. Согласно этому закону, температура кипения вещества повышается с увеличением давления. Кроме того, закон Вант-Гоффа утверждает, что различные вещества имеют одинаковую зависимость температуры кипения от давления при одинаковом молярном объеме и молярной массе.
Суть закона Вант-Гоффа можно выразить следующей формулой:
ln(P1/P2) = ΔH/R (1/T2 - 1/T1),
где P1 и P2 - давления при температурах T1 и T2 соответственно, ΔH - молярная энтальпия парообразования, R - универсальная газовая постоянная. Формула позволяет расчитать изменение температуры кипения при изменении давления.
Закон Вант-Гоффа применим и для смесей веществ. В этом случае каждое вещество в смеси вносит свой вклад в общее поведение системы при изменении давления. Поэтому температура кипения смеси может быть более высокой или более низкой, чем для отдельных веществ, входящих в состав.
Использование закона Вант-Гоффа позволяет предсказать изменение температуры кипения при изменении давления и определить физические и химические свойства вещества. Этот закон имеет важное практическое значение в различных отраслях науки и техники, таких как химия, физика, фармацевтика, пищевая промышленность и др.



