Вторичная структура белков – это специальное пространственное устройство молекулы, которое определяется связями между аминокислотными остатками. Вторичная структура образуется благодаря взаимодействию атомов, а главную роль в этом играют связи водорода. Такие связи представляют собой слабые силы притяжения между донорами водорода и акцепторами, которые обусловлены электростатическими взаимодействиями.
Главными типами связей, обеспечивающими стабилизацию вторичной структуры белков, являются α-спираль и β-складка. В α-спирале полипептидная цепочка сворачивается в спираль, а между отдельными аминокислотами образуются связи водорода. Это позволяет установить стабильное положение цепочки и сохранить ее форму.
В случае с β-складкой аминокислотные остатки располагаются параллельно или антипараллельно друг другу и связываются водородными связями. Благодаря этому образуется стабильная структура, которая является важной для функционирования белка.
Вторичная структура белковой молекулы имеет огромное значение, поскольку она определяет их форму и способность выполнять различные функции в организме. Она может влиять на взаимодействие белка с другими молекулами, его активность и стабильность. Поэтому изучение вторичной структуры белков является важным аспектом биохимии и молекулярной биологии, позволяющим понять механизмы работы белков и разрабатывать новые методы лечения различных заболеваний.
Вторичная структура белковой молекулы и ее значение
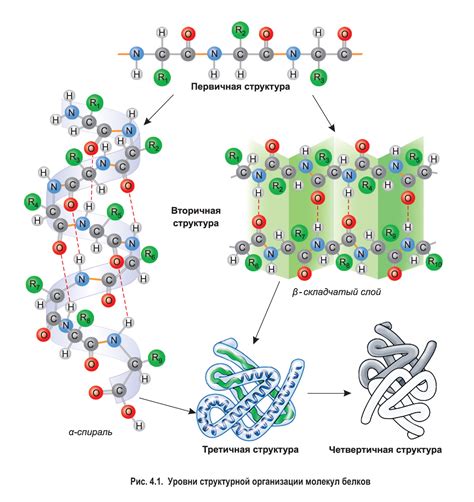
Вторичная структура белковой молекулы состоит из двух основных элементов - альфа-спиралей (алфа-витков) и бета-складок (бета-листов). Альфа-спирали представляют собой спиральные цепи, связанные водородными связями между аминокислотными остатками, в то время как бета-складки образуются при параллельном или антипараллельном расположении соседних аминокислотных остатков.
Вторичная структура белковой молекулы имеет важное значение для ее функционирования. Она обеспечивает молекуле прочность и стабильность, позволяя ей сохранять свою форму и выполнять свою функцию. Кроме того, вторичная структура также определяет возможность взаимодействия белка с другими молекулами и участвует в формировании третичной и кватернической структуры.
Формирование пространственной конформации
Вторичная структура включает в себя α-спирали, β-складки, β-повороты и другие элементы, которые связывают аминокислотные остатки белковой последовательности и образуют характерные участки пространственной конформации.
Одной из ключевых связей, обеспечивающих стабильность вторичной структуры, является водородная связь. Водородные связи возникают между аминокислотными остатками, такими как C=O и N-H группы, и обеспечивают прочное взаимодействие между элементами вторичной структуры.
Кроме водородных связей, стабилизацию вторичной структуры обеспечивают гидрофобные взаимодействия, ионные связи, и дисульфидные мосты. Гидрофобные взаимодействия возникают между неполярными аминокислотами, которые стараются избегать контакта с водой. Ионные связи возникают между заряженными аминокислотными остатками, создавая электростатические взаимодействия. Дисульфидные мосты, в свою очередь, образуются между двумя цистеинами, которые обладают свободными -SH группами.
Вторичная структура белка имеет важное значение, поскольку она определяет его функциональные свойства и способность взаимодействовать с другими молекулами. Кроме того, вторичная структура обеспечивает стабильность белковой молекулы, предотвращая ее разрушение под воздействием физических и химических факторов.
Таким образом, формирование пространственной конформации белковой молекулы является результатом сложной сети связей и взаимодействий, основными элементами которой являются вторичные структуры. Понимание этого процесса позволяет более полно оценить важность вторичной структуры и ее влияние на функцию белковых молекул.
Гидрофобные взаимодействия
Гидрофобные остатки притягиваются друг к другу внутри белковой структуры, тем самым формируя гидрофобные области внутри молекулы, отдельные участки которой связаны друг с другом слабыми силами Ван-дер-Ваальса. Эти силы играют важную роль в поддержании стабильности вторичной структуры белков, таких как альфа-спирали и бета-складки.
Гидрофобные взаимодействия особенно важны в гидрофильной среде, так как они помогают белковой молекуле избегать взаимодействия с водой. Это посредством гидрофобных взаимодействий внутри белковой структуры молекула образует компактную и устойчивую форму, что позволяет белкам выполнять свои функции внутри клеток и организмов.
Понимание гидрофобных взаимодействий и их значения для стабилизации вторичной структуры белков является важным шагом в изучении молекулярных основ биологических процессов и может иметь важные применения в различных областях, таких как разработка новых лекарственных препаратов и биотехнологии.
Водородные связи
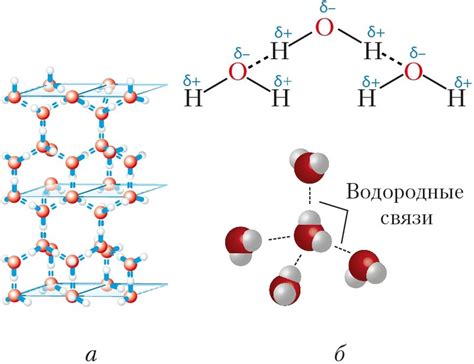
Водородные связи особенно важны для стабилизации спиралевидных структур, таких как α-спираль и β-лист. В α-спирали водородные связи формируются между карбоксильной группой каждого аминокислотного остатка и амидной группой четырех остатков, расположенных в плоскости ниже. В β-листе водородные связи образуются между соседними цепочками аминокислотных остатков, образующими антипараллельные или параллельные ориентации цепочек.
Водородные связи способствуют стабильности вторичной структуры белка, позволяя ему сохранять определенную форму. Благодаря этим связям белковая молекула может выполнять свою функцию в организме и взаимодействовать с другими молекулами. Водородные связи также участвуют в формировании третичной и кватернарной структуры белка, обеспечивая его свертывание и функционирование.
Электростатические взаимодействия

Электростатические взаимодействия возникают между заряженными аминокислотными остатками, такими как аспартат, глутамат, аргинин или лизин. На белоке эти остатки могут быть расположены на разных участках цепи, и электростатические взаимодействия позволяют привлекать эти участки друг к другу, образуя устойчивые структуры.
Такие электростатические взаимодействия также способствуют формированию взаимодействий с другими молекулами, такими как лиганды или другие белки. Они могут участвовать в противодействии факторам, которые могут нарушить структуру белка, и способствовать его стабильности и функционированию.
Таким образом, электростатические взаимодействия играют важную роль в стабилизации вторичной структуры белковой молекулы, обеспечивая ее устойчивость и функциональность.



