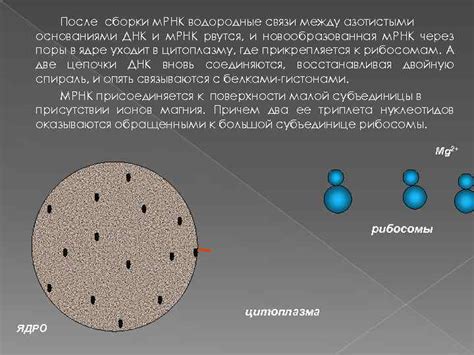
Водородные связи играют важную роль во многих биологических процессах и химических реакциях. В частности, интерес представляет изучение количества водородных связей между азотистыми основаниями - одними из ключевых компонентов ДНК и РНК.
Водородная связь возникает между двумя электроотрицательными атомами - водородным атомом, дающим свой электрон, и еще одним атомом, обладающим электронными облаками. В случае азотистых оснований, таких как аденин (A), тимин (T), цитозин (C) и гуанин (G), система плоского ароматического кольца и наличие донорных атомов азота позволяют образовывать водородные связи с другими основаниями.
Количество водородных связей между азотистыми основаниями может варьироваться в зависимости от комбинации оснований. Например, пары G-C образуют три водородные связи, тогда как пары A-T образуют только две. Это связано с разницей в электроаттракции и расстоянии между донорными и акцепторными атомами в азотистых основаниях.
Действующие силы между азотистыми основаниями
Азотистые основания, такие как аммиак (NH3) и амин (R3N), обладают электронными парами на атоме азота, что позволяет им образовывать водородные связи с другими молекулами.
Водородные связи являются электростатическими взаимодействиями между атомами водорода и атомами электроотрицательных элементов, таких как азот, кислород или фтор. В случае азотистых оснований, действующие силы между азотом и другой молекулой могут быть описаны следующим образом:
| Молекула | Действующая сила |
|---|---|
| Аммиак (NH3) | Водородные связи между азотом и электроотрицательным атомом другой молекулы, например, атомом кислорода (O), азота (N) или фтора (F). |
| Амин (R3N) | Водородные связи между азотом и электроотрицательным атомом другой молекулы, например, атомом кислорода (O), азота (N) или фтора (F). |
Действующие силы между азотистыми основаниями могут играть важную роль в реакциях, связанных с образованием и разрывом связей в молекулах. Они могут влиять на структуру и свойства вещества, включая его кислотность или основность.
Что такое водородные связи?

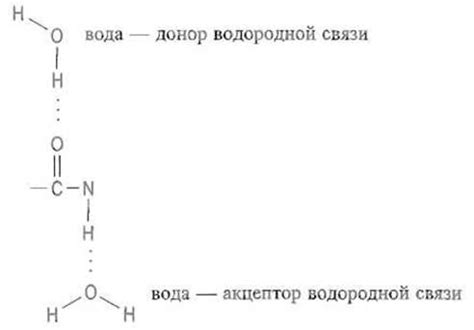
Для образования водородной связи необходимо, чтобы вещество содержало атомы водорода, электроотрицательные атомы (обычно атомы кислорода, азота или фтора) и еще один атом или группу атомов, обладающих свободной электронной парой. Водородный атом выступает в качестве донора, предоставляя электроны, а атом, обладающий свободной электронной парой, - в качестве акцептора, принимает эти электроны.
Водородные связи обладают значительной энергией, поэтому они способны приводить к высокой степени организации и упорядоченности в молекулярных системах. Они обусловливают множество физических и химических свойств веществ, включая высокую температуру кипения и плавления, а также способность многих веществ образовывать кристаллическую решетку.
Водородные связи также играют важную роль в биологических системах. Например, они участвуют в образовании вторичной структуры белков (α-спираль, β-лист) и обеспечивают сворачивание белков в трехмерную структуру. Они также участвуют в образовании двойной спиральной структуры ДНК и взаимодействии между аминокислотами и нуклеотидами.
Как образуются водородные связи?
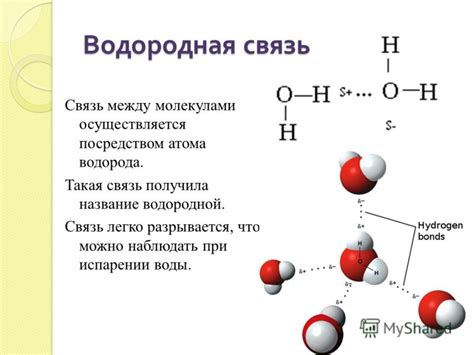
Образование водородных связей происходит за счет притяжения положительно заряженного атома водорода с отрицательно заряженной атомной группой соседней молекулы. Водородная связь образуется, когда атом водорода образует электростатическую связь с атомом кислорода, азота или фтора.
Связь устанавливается при наличии электронного дефицита у атома водорода и электронного избытка у электроотрицательного атома. Атом водорода образует связь с электроотрицательным атомом, притягивая к себе электронную оболочку. Таким образом, образуется электростатическое притяжение, которое удерживает две молекулы вместе.
Водородные связи обладают определенными свойствами и могут быть слабыми или сильными, в зависимости от расстояния между атомами и угла образования. Они могут быть ответственными за структурную устойчивость белков, стабильность ДНК и РНК, а также за различные свойства воды.
Водородные связи играют важную роль в химических и биологических процессах, таких как растворение веществ, формирование молекулярных комплексов и структур, обмен протонами и передача сигналов.
Образование и разрывание водородных связей является динамическим процессом, который может происходить под влиянием внешних условий, таких как температура, давление и растворители.
Важно отметить, что для образования водородных связей необходимо наличие электроотрицательных атомов, способных к образованию связи с атомом водорода.
Основные особенности азотистых оснований

Основные особенности азотистых оснований:
| 1. Образование водородных связей | Атомы азота в азотистых основаниях обладают лонной парой электронов, которая может образовывать водородные связи с молекулами воды или другими азотистыми основаниями. Это делает азотистые основания важными компонентами в многих биологических процессах и химических реакциях. |
| 2. Базические свойства | Азотистые основания обычно обладают базическими свойствами и могут принимать протоны от других молекул. Это связано с наличием азотных атомов, которые способны образовывать ортонравящие связи с протонами. |
| 3. Разнообразие структур | Существуют различные типы азотистых оснований, включая пуриновые основания (аденин и гуанин), пиримидиновые основания (цитозин, тимин и урацил) и другие. Каждый тип имеет уникальную структуру и химические свойства, что определяет их функции и взаимодействия в организме. |
| 4. Участие в формировании нуклеиновых кислот | Азотистые основания являются ключевыми компонентами нуклеиновых кислот, таких как ДНК и РНК, которые играют фундаментальную роль в передаче генетической информации и синтезе белков. Азотистые основания образуют комлементарные пары внутри ДНК и РНК, что обеспечивает их стабильность и способность кодировать генетическую информацию. |
| 5. Роль в биохимических реакциях | Азотистые основания участвуют во многих биохимических реакциях, таких как синтез белков, метаболизм нуклеотидов, обмен азота и другие процессы. Они могут служить катализаторами реакций или быть частью активных центров в ферментах, осуществляющих различные метаболические пути. |
В целом, азотистые основания играют важную роль в химии и биологии, и их изучение позволяет лучше понять основные процессы, происходящие в живых организмах и в химических реакциях. Они являются ключевыми компонентами множества биологически активных соединений и имеют широкий спектр приложений в медицине, сельском хозяйстве и других областях науки и технологий.
Влияние электронной структуры на количество водородных связей
Количество водородных связей между азотистыми основаниями зависит от их электронной структуры. В молекулах азотистых оснований имеются несвязанные пары электронов, которые могут участвовать в образовании водородных связей с другими молекулами.
Электронная структура оснований определяется количеством атомов азота и водорода в их молекулах, а также наличием зарядов и несвязанных электронных пар. Чем больше несвязанных пар электронов имеет основание, тем больше водородных связей оно может образовывать.
Примером может служить аммиак (NH3), в молекуле которого имеется одна несвязанная пара электронов на атоме азота. Эта несвязанная пара может образовывать водородные связи с другими молекулами аммиака, что делает его отличным основанием.
| Основание | Количество атомов азота | Количество несвязанных пар электронов | Количество водородных связей |
|---|---|---|---|
| Аммиак (NH3) | 1 | 1 | 3 |
| Вода (H2O) | 0 | 2 | 2 |
| Мочевина (CH4N2O) | 1 | 2 | 4 |
Как видно из таблицы, количество несвязанных пар электронов влияет на количество водородных связей у оснований. Основания с большим количеством несвязанных пар электронов могут образовывать большее количество водородных связей, что делает их более активными химическими веществами.
Факторы, влияющие на силу водородных связей

Сила водородных связей между азотистыми основаниями может быть подвержена влиянию различных факторов. Ниже приведены основные из них:
- Размер азотистого основания: чем больше азотистое основание, тем сильнее водородные связи. Это связано с тем, что большое азотистое основание создает большую электронную плотность, что усиливает взаимодействие с протонами гидрофильных групп.
- Заряд азотистого основания: положительный заряд азотистого основания может приводить к более сильным водородным связям. Это объясняется тем, что положительный заряд азотистого основания притягивает отрицательно заряженные группы и усиливает электростатическое взаимодействие.
- Наличие дополнительных функциональных групп: наличие дополнительных функциональных групп на азотистом основании может повлиять на силу водородных связей. Например, присутствие в основании карбонильной группы может усилить водородные связи, т.к. карбонильная группа может активно участвовать в водородных связях.
- Взаимодействие с растворителем: растворитель, в котором находится азотистое основание, может влиять на силу водородных связей. Например, протонирование основания в воде может значительно усилить водородные связи, т.к. вода способствует образованию гидрофильных групп и усилению электростатических взаимодействий.
- Температура: температура может влиять на силу водородных связей. Обычно, при повышении температуры сила водородных связей уменьшается. Это объясняется тем, что при повышении температуры увеличивается движение молекул, что ослабляет взаимодействие между азотистыми основаниями.
Таким образом, сила водородных связей между азотистыми основаниями может изменяться под влиянием различных факторов, которые варьируются в зависимости от свойств конкретных азотистых оснований и условий окружающей среды.
Примеры молекул с разным количеством водородных связей

Водородные связи между азотистыми основаниями играют важную роль во многих биологических процессах, таких как синтез белков и процессы репликации ДНК. Различное количество водородных связей влияет на структуру и свойства молекул. Ниже приведены примеры молекул с разным количеством водородных связей:
| Молекула | Количество водородных связей |
|---|---|
| Аденин | 2 |
| Гуанин | 3 |
| Цитозин | 2 |
| Тимин | 1 |
| Урацил | 1 |
Аденин, цитозин и тимин являются основными компонентами нуклеиновых кислот и образуют пары с их комплементарными основаниями: тимин соединяется с аденином, а цитозин с гуанином. Водородные связи с акцепторами водорода могут участвовать в образовании этих пар.
Гуанин имеет одну дополнительную амино-группу, что позволяет ему образовывать дополнительную водородную связь. Это делает его более устойчивым, чем другие азотистые основания.
Тимин и урацил имеют только одну амино-группу, поэтому они образуют только одну водородную связь. Однако, урацил является компонентом РНК, в то время как тимин присутствует только в ДНК.
Значение водородных связей для биологических процессов
Водородные связи играют важную роль в многих биологических процессах, таких как структура и функция белков, распределение воды в организме и составление двойной спирали ДНК.
Водородные связи между азотистыми основаниями в ДНК являются основой для ее структуры и передачи генетической информации. Они обеспечивают стабильность двойной спирали и позволяют парной связи между аденином и тимином, а также между цитозином и гуанином.
В белках водородные связи влияют на их третичную и кватерническую структуру. Они могут образовываться между аминокислотными остатками и определять их положение внутри белка. Это важно для его функционирования и взаимодействия с другими молекулами.
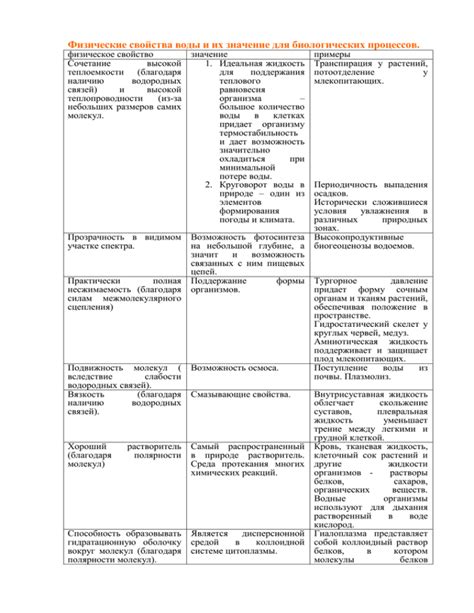
Водородные связи также влияют на способность вещества к образованию растворов. Вода, благодаря водородным связям, обладает высокой термической устойчивостью, превосходной растворимостью различных веществ и способностью к амфотерному поведению.
Понимание роли водородных связей в биологических процессах является краеугольным камнем молекулярной биологии и имеет важное значение для дальнейшего изучения жизни и здоровья организмов.



