Атомы являются основными строительными блоками всего материального мира. Они обладают уникальными характеристиками и играют ключевую роль в объяснении множества физических процессов.
Атомы состоят из трех основных частиц: протонов, нейтронов и электронов. Протоны и нейтроны находятся в центре атома, в ядре, которое обладает положительным зарядом. Электроны, имеющие отрицательный заряд, движутся вокруг ядра по определенным орбитам или энергетическим уровням.
Протоны имеют положительный электрический заряд и определяют атомный номер элемента. Нейтроны не имеют электрического заряда и являются нейтральными частицами. Число протонов и нейтронов в ядре определяет массовое число атома, а разница между массовым числом и атомным числом называется изотопным числом.
Электроны обладают отрицательным зарядом и участвуют в химических реакциях. Они движутся по энергетическим уровням, каждый из которых может содержать определенное число электронов. Электроны находятся в постоянном движении и могут переходить с одного энергетического уровня на другой, поглощая или испуская энергию в виде фотонов.
Атомы как элементарные частицы

Атомы состоят из три основных частиц: протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре атома, в то время как электроны обращаются по орбитам вокруг ядра.
Протоны имеют положительный электрический заряд, в то время как электроны имеют отрицательный заряд. Нейтроны не имеют заряда и являются нейтральными по своим электрическим свойствам.
Число протонов определяет химический элемент, а число нейтронов и электронов в атоме может различаться, образуя такие явления, как изотопы.
Атомы могут соединяться друг с другом, образуя молекулы. Комбинация разных элементов в молекулах позволяет образовывать различные вещества и соединения.
Исследование строения атома и его частиц позволяет понять основные физические и химические процессы, лежащие в основе нашего мира и формирующие его разнообразие.
Таким образом, атомы являются элементарными частицами, основными строительными блоками материи и основой для понимания фундаментальных принципов физики и химии.
Электроны: негативно заряженные элементы атома
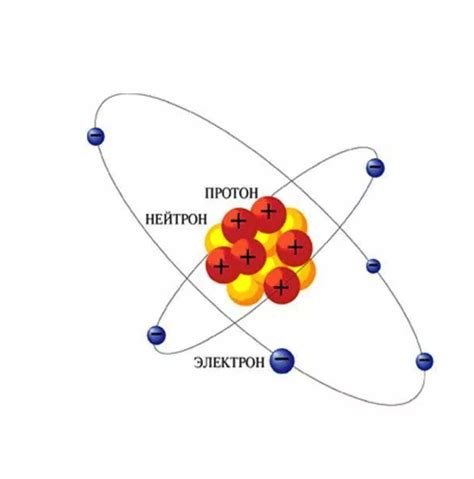
Каждый атом содержит определенное количество электронов, которое определяется его атомным номером. Атомный номер указывает на количество протонов в ядре и, таким образом, определяет количество электронов в атоме в нейтральном состоянии.
Электроны делятся на энергетические уровни, которые представляют собой области пространства вокруг ядра, где вероятность нахождения электрона высока. Первый энергетический уровень может содержать максимум 2 электрона, второй - 8 электронов, третий - 18 электронов и так далее.
Электроны обладают как волновыми, так и частицеподобными свойствами. Их движение можно описать как совокупность волновых функций, которые представляют вероятность обнаружения электрона в определенной области пространства.
Электроны играют важную роль в химических реакциях и связывании атомов в молекулы. Изменение количества электронов в атоме может привести к образованию ионов и изменению химических свойств вещества.
| Электрическая зарядность | Масса (кг) | Масса (аму) |
|---|---|---|
| -1.602 x 10-19 Кл | 9.10938356 x 10-31 кг | 0.00054858 аму |
Протоны: положительно заряженные элементы атома
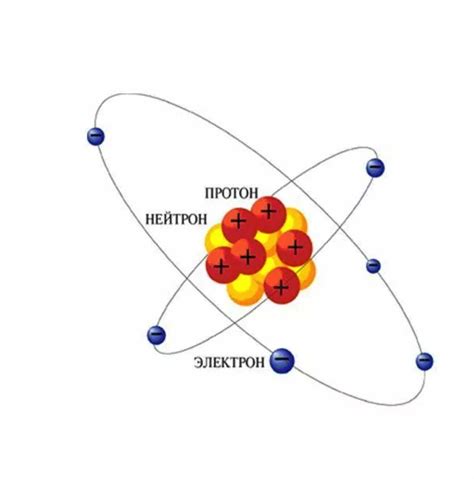
Протоны находятся внутри атомного ядра и объединяются вместе с нейтронами, чтобы образовать ядро атома. Они являются носителями как массы, так и положительного электрического заряда, который компенсируется отрицательно заряженными электронами, находящимися вокруг ядра.
Возможность протонов образовывать связи с другими атомами играет важную роль в химических реакциях. Ведь именно эти электрические связи между атомами определяют структуру и свойства вещества. Также протоны участвуют в формировании ядерного реактора и могут быть облучены, чтобы использоваться в медицинских процедурах.
Таким образом, протоны неотъемлемая часть атома, вносящая важный вклад в его электрическую структуру и свойства. Понимание роли протонов и их основных характеристик является необходимым для изучения строения атомов и их поведения.
Нейтроны: электрически нейтральные элементы атома

Особенность нейтронов заключается в том, что они имеют нейтральный электрический заряд, в отличие от протонов (с положительным зарядом) и электронов (с отрицательным зарядом). Именно присутствие нейтронов в ядре атома позволяет ему обладать стабильностью и предотвращает его разрушение под воздействием электростатического отталкивания протонов.
Масса нейтрона примерно равна массе протона и составляет около 1,67 × 10^-27 килограмма. Однако, в отличие от протона, нейтрон не имеет электрического заряда. Из-за отсутствия электрического взаимодействия, нейтроны могут свободно перемещаться внутри ядра атома.
Нейтроны не обладают электрическим зарядом, но они все же обладают магнитным моментом, что делает их чуть более сложными в изучении и характеризует их взаимодействие с магнитными полями. Магнитное взаимодействие нейтронов с другими частицами может использоваться для исследования структуры атомных ядер.
Нейтроны также играют важную роль в реакциях деления или слияния атомных ядер. Они могут быть поглощены ядром, их возможностей поглощения зависит от типа ядерной реакции. Таким образом, учет нейтронов в атомном ядре имеет фундаментальное значение для прогнозирования поведения ядер во время деления или слияния.
Ядро атома: масса и заряд

Ядро атома представляет собой центральную часть атома, содержащую большую часть его массы. Оно состоит из протонов и нейтронов. Протоны имеют положительный заряд, а нейтроны не имеют заряда.
Протоны и нейтроны обладают примерно одинаковой массой, которая составляет примерно 99,9% от общей массы атома. Масса протона составляет примерно 1,67262 x 10^(-27) килограмма, а масса нейтрона - примерно 1,67493 x 10^(-27) килограмма.
| Частица | Масса (кг) | Заряд (Кл) |
|---|---|---|
| Протон | 1,67262 x 10^(-27) | 1,60219 x 10^(-19) |
| Нейтрон | 1,67493 x 10^(-27) | 0 |
Заряд протона составляет примерно 1,60219 x 10^(-19) Кл, а нейтрона не имеют заряда. Таким образом, общий заряд ядра атома определяется количеством протонов, которое равно атомному номеру элемента. Если количество протонов и электронов в атоме одинаково, то атом является нейтральным. Если количество протонов и электронов различно, то атом имеет заряд и является ионом.
Знание о массе и заряде ядра атома позволяет понять, как происходят различные ядерные реакции и изменения в структуре атомов. Основные свойства ядра играют важную роль в изучении физики и химии, а также в промышленности и медицине.
Энергетические уровни атома
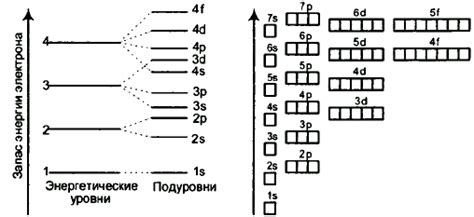
Атомы состоят из электронов, которые движутся вокруг ядра. Электроны размещаются на разных энергетических уровнях, которые образуют энергетическую оболочку атома.
Каждый энергетический уровень имеет определенную энергию, которая определяется расстоянием от электрона до ядра. Чем ближе электрон к ядру, тем меньше энергии он имеет.
Энергетические уровни атома нумеруются числами и обозначаются латинскими буквами: K, L, M, N и т.д. Уровень K является ближайшим к ядру и имеет наименьшую энергию, а каждый следующий уровень имеет большую энергию, чем предыдущий.
На каждом энергетическом уровне могут размещаться определенное количество электронов. Уровень K может вмещать до 2 электронов, L - до 8 электронов, M - до 18 электронов, N - до 32 электронов и так далее.
Энергетические уровни атома играют важную роль в химических реакциях и определяют свойства атома. Передача энергии между электронами на разных уровнях может привести к изменению состояния атома и возникновению новых связей с другими атомами.
Квантовая механика и орбитали

Орбитали – это математические функции, используемые для описания возможного расположения электрона вокруг атомного ядра. Одна орбиталь может вмещать два электрона с противоположными спинами, согласно принципу Паули.
Квантовая механика предсказывает наличие четырех основных типов орбиталей: s, p, d и f. Они отличаются формой и ориентацией в пространстве, а также энергетическим уровнем. Орбитали с низкими энергетическими уровнями находятся ближе к ядру и заполняются электронами в первую очередь.
Орбитали s имеют форму сферы и симметричны относительно ядра. Они встречаются в первой энергетической оболочке.
Орбитали p представляют собой трехмерные фигуры в форме шестиугольной призмы. Они находятся во второй энергетической оболочке и ориентированы вдоль трех ортогональных осей.
Орбитали d имеют более сложную форму и находятся в третьей энергетической оболочке. Они представляют собой фигуры с многочисленными петлями и узлами.
Орбитали f имеют самую сложную форму и находятся в четвертой энергетической оболочке. Они также имеют многочисленные петли и узлы, но еще более сложны по своей структуре.
Орбитали играют важную роль в химических реакциях и свойствах атомов и молекул. Их форма и энергия влияют на вероятность нахождения электронов в определенных областях вокруг ядра и определяют, как электроны могут соединяться с другими атомами для формирования связей.
Квантовая механика и орбитали являются неотъемлемыми компонентами для понимания строения и свойств атомов. Они позволяют объяснить множество физических и химических явлений, которые наблюдаются в микромире.
Ионы атомов: положительно и отрицательно заряженные
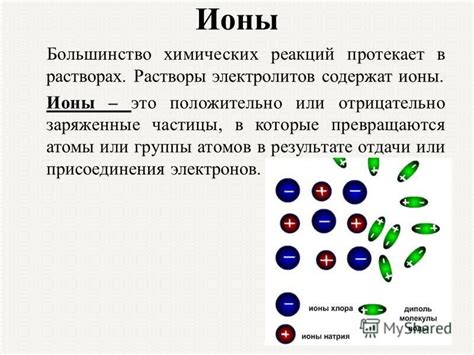
Ионы атомов возникают, когда атомы теряют или приобретают электроны. Следовательно, они могут быть положительно или отрицательно заряженными.
Положительно заряженные ионы, называемые катионами, образуются, когда атом теряет один или несколько электронов. Такие ионы имеют большее количество протонов, чем электронов.
Отрицательно заряженные ионы, называются анионами, образуются, когда атом приобретает один или несколько электронов. В таких ионах количество электронов больше, чем протонов.
Электрическая зарядка ионов позволяет им взаимодействовать с другими атомами или ионами, что обуславливает множество химических реакций и свойств веществ.
Наличие положительно и отрицательно заряженных ионов вещества играет важную роль в электролите, проводимости электричества и многих других процессах в различных областях науки и технологий.
Периодическая система элементов и строение атомов

Строение атомов, которое отражается в периодической системе элементов, основано на их электронной конфигурации. Атом состоит из ядра, в котором находятся протоны и нейтроны, а также электронной оболочки, на которой располагаются электроны.
Модель атома Нильса Бора помогла объяснить структуру атома. По этой модели, электроны находятся на различных энергетических уровнях или оболочках, каждая из которых может содержать определенное количество электронов. Наиболее близка к ядру находится первая оболочка, которая может содержать максимум 2 электрона. Вторая оболочка может содержать до 8 электронов, а третья - до 18.
Все элементы периодической системы элементов разделены на блоки: s-блок, p-блок, d-блок и f-блок. В s-блоке находятся элементы с заполненными или неполностью заполненными s-оболочками. В p-блоке находятся элементы, у которых заполнены p-оболочки. В d-блоке расположены элементы с заполненными d-оболочками, а в f-блоке - с заполненными f-оболочками.
Период - это горизонтальная строка в таблице, а группа - вертикальная столбец. Периоды указывают на количество энергетических уровней, на которых расположены электроны в атоме. Группы указывают на количество электронов в наружной оболочке элемента. Наиболее важные группы - группа 1 (щелочные металлы), группа 2 (щелочноземельные металлы), группы с 3 по 12 (переходные металлы), группа 17 (галогены) и группа 18 (инертные газы).
- Атомные номера в периодической системе элементов расположены слева от символа элемента и увеличиваются по мере увеличения атомной массы.
- Символы элементов указываются справа от атомных номеров и используются для обозначения элементов.
- Относительные атомные массы указываются под символом элемента.
Понимание периодической системы элементов и строения атомов позволяет ученым предсказывать свойства и взаимодействия различных элементов. Это также помогает увидеть связь между элементами и понять, как они участвуют в химических реакциях и образовании соединений.



