Когда мы говорим о весе атома, мы говорим о его массе. Атом водорода является самым легким атомом в таблице элементов. Его атомная масса равна примерно 1.008 грамма на моль. Таким образом, чтобы узнать вес одного атома водорода, необходимо разделить его атомную массу на Авогадро число.
Авогадро число, обозначаемое как NA, равно примерно 6.022 x 1023 атомов на моль. Это число было получено в результате экспериментов, проведенных итальянским ученым Амедео Авогадро в начале 19-го века. Он установил, что одна и та же объемная доля любого идеального газа при одинаковых условиях температуры и давления содержит одинаковое число молекул или атомов.
Таким образом, чтобы найти вес одного атома водорода, мы делим его атомную массу на число Авогадро:
Вес одного атома водорода = Атомная масса водорода / Авогадро число = 1.008 г / (6.022 x 1023)
Таким образом, вес одного атома водорода составляет примерно 1.673 x 10-24 грамма. Это крайне маленькое значение, показывающее, насколько малыми являются атомы.
Вес атома водорода в граммах
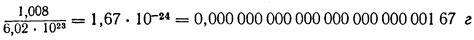
Хотя вопрос "Сколько весит 1 атом водорода в граммах?" поставлен в группе граммов, грамм - это единица массы, используемая для обычных предметов, а не для атомных частиц. Вес одного атома водорода в граммах можно рассчитать, зная его молярную массу.
Итак, молярная масса водорода равна 1,00784 г/моль. Чтобы узнать, сколько весит 1 атом водорода, нужно разделить массу одного моля водорода на Авогадро́вское число (6,022 × 10^23). Формула, которую мы используем:
- Расчитаем массу одного моля водорода:
- Ответ: 1 атом водорода весит примерно 1,674 × 10^-24 грамма.
1,00784 г/моль ÷ 6,022 × 10^23 атомов/моль = 1,674 × 10^-24 г/атом
Таким образом, хотя масса одного атома водорода на самом деле крайне мала, и его измерение в граммах не является практичным, мы можем рассчитать приблизительную массу одного атома водорода.
Атом водорода: структура и свойства
Протон находится в ядре атома и имеет положительный заряд. Электрон, с отрицательным зарядом, находится вокруг ядра в области, называемой электронной оболочкой.
Атом водорода обладает рядом уникальных свойств:
- Масса атома: Масса одного атома водорода составляет примерно 1 грамм/моль.
- Электротивность: Водород обладает наибольшей электротивностью среди всех элементов. Это свойство делает его важным в составе многих соединений и химических реакций.
- Изотопы: Водород имеет три изотопа: обычный водород (протий), дейтерий и тритий. Изотопы водорода отличаются количеством нейтронов в ядре и, соответственно, массой.
- Реактивность: Атом водорода очень реактивен и может образовывать связи с другими атомами, например, с кислородом и углеродом. Это делает водород важной частью многих органических и неорганических соединений.
Изучение атома водорода позволяет понять основы химии, структуру и свойства других элементов, а также применения водорода в различных областях науки и технологий.
Единицы измерения веса атома
Еще одна используемая единица измерения – грамм-атом (gram-atom), которая определяется как масса одного моля атомов определенного элемента в граммах. Таким образом, масса одного атома водорода соответствует приблизительно 1 грамму/моль.
Также стоит упомянуть еще одну единицу измерения, используемую для веса атома – килограмм-атом (kilogram-atom), которая определяется как масса одного моля атомов определенного элемента в килограммах. Вес одного атома водорода составляет приблизительно 0.001 килограмма/моль.
Истинная масса одного атома водорода составляет около 1.673 * 10^(-24) грамма или 1.673 * 10^(-27) килограмма. Однако, для удобства расчетов и коммуникации, обычно используются приближенные значения веса атома в различных единицах измерения.
Средняя масса атома водорода

В случае атома водорода, его атомный номер равен 1, а атомная масса примерно равна 1.00784 атомных единиц массы (а.е.м.).
Однако, в природе встречаются два стабильных изотопа водорода - протий (1H) и дейтерий (2H). Протий существует в одном экземпляре на 99.98%, а дейтерий - на 0.02%. Следовательно, средняя атомная масса водорода получается путем учета доли этих изотопов:
| Изотоп | Атомная масса (а.е.м.) | Доля присутствия (%) |
|---|---|---|
| Протий (1H) | 1.007825 | 99.98 |
| Дейтерий (2H) | 2.014 | 0.02 |
Для расчета средней массы атома водорода, нужно умножить атомную массу каждого изотопа на его долю присутствия, а затем сложить результаты:
Средняя масса атома водорода = (1.007825 * 99.98 + 2.014 * 0.02) / 100 = 1.00794 а.е.м.
Таким образом, средняя масса атома водорода примерно равна 1.00794 атомных единиц массы.
Расчет веса одного атома водорода

Масса одного атома водорода составляет приблизительно 1.007825 аму. Аму - это единица измерения, используемая в атомной и ядерной физике для указания массы атомов и молекул.
Для перевода массы из атомных единиц в граммы, необходимо учесть, что 1 атомная единица массы (аму) равна приблизительно 1.661 x 10-24 грамма.
Таким образом, вес одного атома водорода составляет приблизительно (1.007825) x (1.661 x 10-24) грамма.
Этот результат можно округлить, чтобы получить более удобное значение. В итоге, вес одного атома водорода составляет около 1.67 x 10-24 грамма.
Знание веса одного атома водорода в граммах полезно при проведении различных расчетов и изучении химических реакций, в которых участвует водород.
Экспериментальные данные

Для определения массы атомов были проведены различные эксперименты, основанные на измерении различных физических свойств.
Одним из методов является измерение отношения массы атомов вещества к их заряду. Этот метод используется для определения массы атомов методом масс-спектрометрии.
Другим методом является измерение массы атомов на основе анализа изотопов, которые составляют атомы вещества. Как известно, в водороде существует три изотопа: процентное содержание одного из них, дейтерия, составляет около 0.015%, остальные атомы водорода представлены обычным протий тяжелого или обычного водорода. Измерение массы атомов основывается на их относительных абундансах и изотопических массах.
| Изотоп | Относительная абунданса (%) | Масса атома (г/моль) |
|---|---|---|
| Протий (1H) | 99.985 | 1.00784 |
| Дейтерий (2H) | 0.015 | 2.014102 |
Исходя из этих данных, можно рассчитать среднюю массу атома водорода, используя следующую формулу:
Средняя масса атома = (процентное содержание атома 1H * масса атома 1H) + (процентное содержание атома 2H * масса атома 2H)
Средняя масса атома водорода равна примерно 1.00794 г/моль.
Значение веса атома водорода в граммах

Масса атома водорода составляет около 1 атомной массы и приблизительно равна 1,673 × 10-24 грамма.
Для удобства измерения малых масс, вместо грамма используется единица измерения массы - атомная массовая единица (аму). В 1 грамме содержится около 6,022 × 1023 атомов водорода. Таким образом, масса 1 атома водорода составляет примерно 1,00784 аму.
| Атомный номер | Символ элемента | Молекулярная масса (г/моль) | Масса 1 атома (г) |
|---|---|---|---|
| 1 | H | 1,00784 | 1,673 × 10-24 |
Знание значения массы атома водорода в граммах важно для различных физическо-химических расчетов, а также для понимания свойств и структуры этого элемента.



