Железо (Fe) - один из наиболее распространенных металлов в земной коре, и его влияние на жизнь человека сложно переоценить. При этом, железо имеет ряд уникальных свойств, которые определяют его широкий спектр применений. Одним из таких свойств является его способность образовывать валентные электроны - электроны, участвующие в химических реакциях и определяющие химические свойства вещества.
В основном состоянии железо имеет атомный номер 26, что означает наличие 26 электронов в атоме. Однако, не все эти электроны могут быть рассмотрены как валентные. Ведь, валентные электроны - это те, которые находятся на наиболее удаленных от ядра энергетических уровнях и могут участвовать в химических взаимодействиях.
У железа в основном состоянии наибольшая энергия связи имеют первые 18 электронов, которые заполняют уровни с $1s$ до $3d$. Таким образом, именно эти 18 электронов можно считать валентными при рассмотрении химических реакций с участием железа. Они определяют способность железа образовывать соединения с другими элементами и его химические свойства.
Определение и значение валентных электронов

| Атом | Атомный номер | Валентность |
|---|---|---|
| Fe | 26 | 2 |
Строение атома железа и его основное состояние
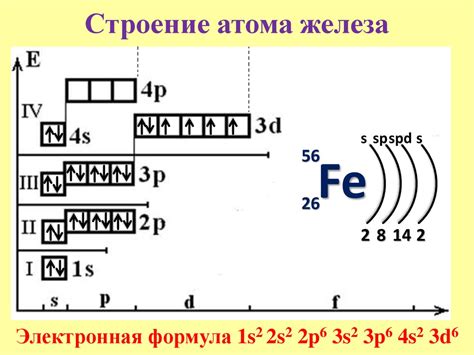
Атом железа, химический элемент с атомным номером 26, имеет сложную структуру. В его ядре содержится 26 протонов и, в обычном случае, также 26 нейтронов. Протоны обладают положительным зарядом, а нейтроны не имеют заряда, что делает ядро атома железа положительно заряженным.
Круглый электронный облако, которое окружает ядро, представляет собой область, в которой находятся электроны. Количество электронов в облаке определяется атомным числом, которое для железа равно 26.
Далее, электроны располагаются на электронных оболочках вокруг ядра. Первая оболочка может содержать до 2 электронов, вторая - до 8 электронов, третья - до 14 электронов, а четвертая и следующие - до 32 электронов.
Основное состояние атома железа характеризуется тем, что все его оболочки, кроме последней, заполнены электронами неполностью. У атома железа 26 электронов, значит, последняя оболочка будет содержать 2 электрона.
Следовательно, в основном состоянии атом железа имеет 2 валентных электрона.
Количество валентных электронов у железа в основном состоянии
В данном случае, электронная конфигурация внешней оболочки железа состоит из оболочек 4s и 3d, что означает, что у железа в основном состоянии имеется 2 валентных электрона.
Валентные электроны - это электроны, находящиеся в наиболее высокой энергетической оболочке и отвечающие за валентность элемента. У железа в основном состоянии имеются два валентных электрона, которые могут использоваться для образования химических связей и реакций с другими элементами.
Значение количества валентных электронов для свойств железа

Количество валентных электронов в атоме железа имеет важное значение для его свойств и реактивности. В основном состоянии железа находятся два валентных электрона, расположенных в 4s-подуровне. Эти электроны обладают высокой энергией и могут легко участвовать в химических реакциях.
Количество валентных электронов определяет реакционную способность железа и способность образовывать химические связи с другими атомами. За счет наличия двух валентных электронов, железо может образовывать связи с другими элементами, например, с кислородом, азотом или серой.
Свойства железа, такие как его магнитные и электрические свойства, также связаны с его валентными электронами. Две валентные электроны в 4s-подуровне позволяют железу образовывать спиновые пары электронов, отвечающие за его магнитные свойства. Кроме того, эти электроны также могут участвовать в переносе электрического заряда, влияя на электрические свойства железа.
Таким образом, количество валентных электронов в атоме железа играет важную роль в его свойствах и реакционности, определяя его способность образовывать химические связи, его магнитные и электрические свойства.



