Водные растворы солей, обладающие множеством уникальных свойств и способностей, являются одним из основных объектов изучения в химии. По своей сути соли - это химические соединения, состоящие из катионов и анионов, которые способны образовывать водные растворы, обладающие своими характеристиками.
Одной из важнейших особенностей водных растворов солей является их способность образовывать электролитические растворы. Это означает, что соли в растворе распадаются на ионы - положительно заряженные катионы и отрицательно заряженные анионы. Ионы получаются в результате диссоциации молекул солей под действием воды.
Конкретный состав и свойства водного раствора зависят от химического состава солей. Так, некоторые соли могут быть нейтральными или слабокислыми, а другие - щелочными или кислыми. От реакции соли с водой зависит также степень растворимости соли - насколько соль будет хорошо или плохо растворяться в воде.
Формирование ионов
Водные растворы солей обладают способностью образовывать ионы, что определяет их особую реактивность. Процесс формирования ионов в водных растворах солей называется ионизацией.
Когда соль попадает в воду, молекулы воды (H2O) разделяются на положительные и отрицательные ионы. Положительный ион образуется путем отрыва одного или нескольких электронов от атомов соли, при этом атом приобретает положительный заряд. Отрицательный ион формируется за счет присоединения одного или нескольких электронов к атому соли, в результате чего атом приобретает отрицательный заряд.
Формирование ионов в водных растворах солей является важным исходным этапом многих химических реакций. Ионы, образовавшиеся в результате ионизации, могут третироваться с другими ионами или молекулами с помощью различных химических реакций, в результате которых образуются новые вещества.
Ионизация солей в водных растворах играет ключевую роль в таких процессах, как электролиз, кислотно-щелочные реакции, образование осадков и многие другие химические превращения.
Распад солей
Распад солей происходит, потому что вода является полиарной молекулой, то есть имеет возможность образовывать водородные связи. Когда соль попадает в воду, водные молекулы начинают образовывать вокруг солевых ионов оболочку, называемую гидратной оболочкой. Гидратация солевых ионов приводит к их разделению и образованию ионов водорода (H+) и ОH-.
Схематично процесс распада солей можно описать с помощью следующей таблицы:
| Соль | Происходящая реакция |
|---|---|
| Кислый катион, нейтральный анион | H+ + OH- -> H2O |
| Нейтральный катион, кислотный анион | H+ + A- -> HA (кислота) |
| Основный катион, нейтральный анион | OH- + B+ -> BOH (щелочь) |
Как видно из таблицы, в результате гидролиза солей могут образовываться как кислоты, так и щелочи. Такое поведение зависит от свойств катионов и анионов, которые образуют данную соль. Катионы металлов, обладающие высокой электроотрицательностью, могут образовывать щелочные растворы, тогда как анионы не металлов с высокой электроотрицательностью могут образовывать кислоты.
Распад солей в водных растворах имеет важное значение в химических реакциях и в жизнедеятельности многих организмов. Он позволяет регулировать pH среды, а также обеспечивает поступление необходимых для организма ионов.
Реакция растворов солей с водой

Водные растворы солей проявляют различные реакции при взаимодействии с водой. Эти реакции определяются свойствами и составом солей.
Многие соли, при попадании в воду, диссоциируют на ионы, образуя ионные растворы. В таких растворах соли присутствуют в виде отдельных положительных и отрицательных ионов, которые окружены молекулами воды. Диссоциация солей в воде происходит в результате поляризации ионных связей при взаимодействии с полярной молекулой воды.
Растворы некоторых солей проявляют кислотные или щелочные свойства. Это связано с их способностью либо отдавать в воду протоны (кислоты), либо принимать протоны от воды (основания). Такие соли называют амфотерными. Их реакция с водой может протекать в обоих направлениях и зависит от pH среды.
Некоторые соли проявляют особенные свойства, например, соли сильных кислот и сильных оснований не образуют ионные растворы, а остаются в виде недиссоциированных молекул в воде. Такие растворы называют насыщенными или нерастворимыми.
Реакция растворов солей с водой может быть сопровождена образованием осадков или изменением окраски растворов. Это связано с образованием новых соединений, в результате которых происходит выпадение нерастворимых веществ.
Таким образом, реакция растворов солей с водой зависит от вида соли и ее свойств, а также от условий, в которых проходит взаимодействие.
Образование ионного кристалла
Водные растворы солей проявляют особую реакцию, которая связана с образованием ионного кристалла. Когда соль растворяется в воде, ее молекулы разделяются на положительно и отрицательно заряженные ионы. Данный процесс называется диссоциацией.
Для примера рассмотрим растворение NaCl (хлорида натрия) в воде. Когда NaCl попадает в воду, молекулы соли разделяются на катион натрия (Na+) и анион хлорида (Cl-). Каждая из этих частей пропорционально притягивает молекулы воды своим зарядом и окружается ими. Таким образом, образуется гидратная оболочка вокруг каждого иона. Это образование оболочки и приводит к образованию ионного кристалла.
Ионный кристалл представляет собой трехмерную решетку, в которой положительные ионы располагаются регулярно с отрицательными ионами внутри. Эта структура обеспечивает водным растворам солей такие особенности, как высокая электропроводность и способность проводить электрический ток.
| Пример: NaCl в воде | ||
|---|---|---|
| NaCl | Na+ | Cl- |
| Вода | ― | H2O |
| Образование гидратной оболочки | H2O | H2O |
| Образование ионного кристалла | Na+ | Cl- |
Образование ионного кристалла в водных растворах солей является важным процессом, который определяет множество химических и физических свойств данных растворов. Это объясняет, почему водные растворы солей имеют высокую электропроводность и способность проводить электрический ток.
Свойства водных растворов солей
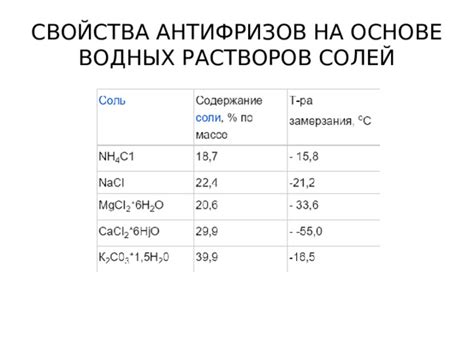
Водные растворы солей проявляют ряд уникальных свойств, которые определяются их химической структурой и взаимодействием с водой.
Электролитическая диссоциация:
Соли, попавшие в воду, подвергаются процессу электролитической диссоциации. В результате этого процесса соляные кристаллы разбиваются на ионы, которые омываются молекулами воды. Таким образом, раствор соли становится проводимым для электрического тока.
Ионизация:
Водные растворы солей ионизируются в воде, образуя положительно и отрицательно заряженные ионы. Это является причиной их способности реагировать с другими веществами и участвовать в химических реакциях.
Реакции с водой:
Многие соли обладают способностью взаимодействовать с водой. Такие реакции могут протекать с выделением тепла или поглощением его из окружающей среды. Например, хлорид натрия при контакте с водой образует щелочную среду и высвобождает газ хлороводород.
Физические свойства:
Водные растворы солей могут иметь различные физические свойства, такие как цвет, вкус, запах и степень прозрачности. Например, растворы солей переходных металлов могут обладать яркой окраской, а сахараты - сладким вкусом.
Влияние на pH:
Соли, растворенные в воде, могут изменять ее pH. Некоторые соли обладают кислыми свойствами и уменьшают pH раствора, в то время как другие соли могут быть щелочными и повышать его. Это свойство может использоваться для регулирования pH в различных процессах и веществах.
Таким образом, водные растворы солей проявляют разнообразные свойства, определяющие их поведение и возможность использования в различных химических и физических процессах.
Образование индикаторных переходов
Образование индикаторных переходов связано с изменением pH раствора. Цвет индикатора зависит от pH, поэтому при изменении кислотно-щелочного состояния раствора меняется и цвет индикатора.
Например, при добавлении индикатора фенолфталеина в щелочной раствор происходит индикаторный переход: он становится красным. Если добавить этот индикатор в кислотный раствор, он останется без цвета. Таким образом, индикаторные переходы позволяют определить, кислотный или щелочной раствор находится перед нами.
Индикаторы важны для химических исследований, а также для контроля pH в различных отраслях промышленности. Они позволяют быстро и легко определить химическую природу раствора и принять необходимые меры.
Влияние концентрации солей
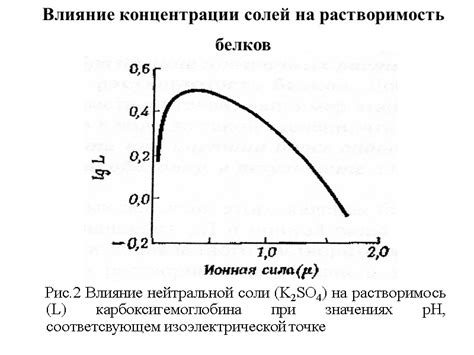
Концентрация солей в водных растворах играет важную роль в их химическом поведении и реакциях. Она оказывает влияние на скорость химических реакций, изменяет pH раствора и может вызывать образование осадков или химическое разложение веществ.
Повышенная концентрация солей может увеличить скорость реакции, так как большее количество реагентов присутствует в растворе, что повышает вероятность их взаимодействия. Однако, при крайне высоких концентрациях солей, наблюдается явление супернасыщения, когда раствор становится нестабильным и происходит выпадение осадка.
Кроме того, концентрация солей может изменять pH раствора. Некоторые соли могут быть амфотерными и изменять свою реакционную способность в зависимости от концентрации. Например, алюминий в низкоконцентрированных растворах может действовать как кислота, а в высококонцентрированных растворах - как основание.
Концентрация солей также может оказывать влияние на их растворимость. Некоторые соли могут быть легко растворимы при низкой концентрации, но образовывать осадок при повышении концентрации. Например, серебро хорошо растворяется в низкоконцентрированных растворах, но при достижении определенной концентрации выпадает в осадок в виде серебряного хлорида.
Таким образом, концентрация солей в водных растворах имеет значительное влияние на их химическое поведение и может вызывать различные реакции, изменения pH и образование осадков.
Использование солей в быту

Соли имеют широкое применение в бытовых целях благодаря своим разнообразным свойствам. Они используются в различных сферах, таких как:
1. Кулинария. Соли являются неотъемлемой частью пищи и используются для улучшения вкуса и сохранения продуктов. Они дают пище определенное оттенение, усиливают или ослабляют вкус, а также обеспечивают его равномерное распределение по всей поверхности блюда.
2. Уборка. Соли могут использоваться для устранения различных пятен и загрязнений на поверхностях. Так, соль с лимонным соком помогает удалить пятна от кофе, чая и сока. Соль также может быть использована для прочистки засоров в раковине или водостоке.
3. Уход за кожей. Некоторые соли, такие как морская соль, используются в косметических целях. Они помогают очищать и увлажнять кожу, улучшают ее текстуру и тонус. Солевые скрабы также помогают снять омертвевшие клетки кожи и разглаживают ее поверхность.
4. Средства для ухода за волосами. Соли, такие как морская соль, магниевая соль и другие, используются в шампунях и других продуктах для укладки волос. Они помогают придать волосам объем и текстуру, а также улучшить их состояние и блеск.
5. Агрохимия. В сельском хозяйстве соли широко используются как удобрения для повышения плодородия почвы. Они способствуют нормализации pH-уровня почвы, обеспечивают необходимые элементы питания для растений и помогают предотвращать различные болезни и вредители.
Все эти примеры подтверждают многообразие и полезность солей в быту. Они являются незаменимыми агентами для различных задач, их многогранность свойств делает их неотъемлемой частью нашей повседневной жизни.
Выделение солей из растворов

Этот метод основан на том, что при нагревании водного раствора соль остается на дне или стенках сосуда, а вода испаряется. Таким образом, можно получить чистое вещество - соль.
Другим способом выделения солей из растворов является добавление к ним реагента, который образует с солью нерастворимые соединения. Такие соединения называются осадками. Они выпадают в виде твердого вещества и могут быть отделены от раствора например, фильтрованием.
Важно помнить, что выделение солей из растворов может быть опасным процессом. Некоторые соли являются токсичными или реагируют с другими веществами, образуя взрывоопасные соединения. Поэтому при выделении солей необходимо соблюдать осторожность и проводить эксперименты только в соответствии с правилами и инструкциями по безопасности.
Влияние температуры на реакцию солей с водой

Температура играет важную роль в реакции между солями и водой. Эта физическая величина способна значительно влиять на скорость и характер процесса растворения.
При повышении температуры вода приобретает большую энергию, что приводит к увеличению частоты столкновений между молекулами воды и ионами соли. Это позволяет соли быстрее растворяться в воде и способствует увеличению их растворимости.
При нагревании солей, которые образуют эндотермические реакции растворения, процесс растворения становится энергетически более выгодным. Такие соли могут обладать низкой растворимостью при комнатной температуре, но при нагревании они могут полностью раствориться. Примерами могут служить карбид кальция (CaC2) или сульфат меди (CuSO4).
Однако, при нагревании солей, которые образуют экзотермические реакции растворения, процесс растворения может замедляться. Экзотермическая реакция сопровождается выделением тепла, поэтому при нагревании энергия реакции увеличивается, что может привести к осаждению вещества. Примером такой соли является хлорид натрия (NaCl), который при нагревании могут образовываться кристаллы.
Таким образом, температура играет важную роль в реакции солей с водой. Она влияет на скорость растворения солей и их растворимость, а также может изменять характер процесса, приводя к образованию растворов или осадков.



