Реакция соляной кислоты с медью является одним из классических примеров химической реакции, которая проявляет сложный характер и вызывает весьма интересные последствия. Вопрос о том, почему реакция именно с медью настолько заметна, а не с любым другим металлом, кроется во множестве факторов и особенностях данного металла.
Понимание механизма реакции соляной кислоты с медью становится возможным, если рассмотреть его химическую структуру и свойства. Во-первых, медь представляет собой металл, обладающий отличной электропроводностью и высокой плотностью. Это позволяет ей быть активным участником реакции, в которой происходит обмен электронами между медью и атомами водорода из соляной кислоты.
Уникальность реакции соляной кислоты с медью также вызывается влиянием окружающей среды на ее протекание. Стивения Голланда и Мартена Терваерта, два голландских химика, предложили объяснение этому явлению во второй половине 20-го века. Согласно их теории, реакция соляной кислоты с медью происходит в несколько этапов, каждый из которых характеризуется определенным типом взаимодействия между составляющими.
Причины и объяснения проблем, возникающих при реакции соляной кислоты с медью
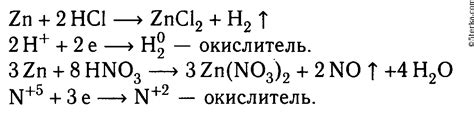
Соляная кислота является сильным окислителем и способна окислить медь до иона Cu2+. В результате происходит образование соединения CuCl2, которое может представлять собой растворимую вещество или образовывать осадок, в зависимости от условий реакции.
Еще одной проблемой может быть действие гидроксидных и сульфидных ионов, которые могут присутствовать в соляной кислоте в виде примесей. Эти ионы могут образовывать нерастворимые соединения с медью, такие как гидроксид меди (Cu(OH)2) или сульфид меди (CuS). Это приводит к образованию осадка и мешает проведению реакции.
Кроме того, при взаимодействии соляной кислоты с медью может происходить образование хлоридных газов, таких как хлор водородный (HCl) или хлорид меди (CuCl). Эти газы могут быть ядовитыми и вызывать раздражение дыхательных путей.
Для устранения этих проблем рекомендуется проводить реакцию в хорошо вентилируемом помещении или под вытяжкой. Также можно использовать специальные методы обработки меди, такие как покрытие ее защитными слоями или использование инертных газов, чтобы предотвратить окисление и коррозию меди.
| Реакция | Уравнение реакции | Продукты реакции |
|---|---|---|
| Образование растворимого осадка | HCl + Cu -> CuCl2 + Н2 | Растворимый хлорид меди и газ водород |
| Образование нерастворимого осадка | HCl + Cu(OH)2 -> CuCl2 + 2H2O | Нерастворимый хлорид меди и вода |
Химическое взаимодействие между соляной кислотой и медью
Введение
Химическое взаимодействие между соляной кислотой (HCl) и медью (Cu) является одной из важных реакций в химии. Как известно, соляная кислота - это сильная двухзамещенная кислота, а медь - это химически активный и электропроводный металл из группы переходных металлов.
Процесс реакции
При реакции соляной кислоты с медью образуется хлорид меди (CuCl2) и обычно выделяется водород (H2). Реакция происходит следующим образом:
2HCl + Cu → CuCl2 + H2
Во время реакции, ионы меди (Cu2+) окисляются, а водород (H2) выделяется в виде газа. Образовавшийся хлорид меди (CuCl2) растворяется в соляной кислоте, образуя ионный комплекс солята меди
Причины и объяснения
Основной причиной химической реакции между соляной кислотой и медью является высокая активность меди и ее способность окисляться. Медь встречается в двух различных окисленных состояниях: Cu(0) (элементарная медь) и Cu(II) (ион меди).
Входящая в состав соляной кислоты вода, HCl, является электролитом, что позволяет проводить электролитическую реакцию и приводит к образованию ионов водорода (H+). Таким образом, происходит окисление меди, а ионы меди Cu2+ и ионы водорода H+ образуют водородное соединение (H2), которое выделяется в виде газа.
Заключение
Химическое взаимодействие между соляной кислотой и медью является реакцией окисления-восстановления. Медь окисляется, а соляная кислота восстановляется. Эта реакция широко используется в промышленности и лаборатории, и имеет большое практическое значение.
Образование хлорида меди

Реакция между медью и соляной кислотой может быть представлена следующим уравнением:
Cu + 2HCl → CuCl2 + H2
Во время этой реакции атомы меди, обладающие положительным зарядом, взаимодействуют с анионами хлора в соляной кислоте. Это приводит к образованию молекул хлорида меди и молекул водорода во время реакции.
Хлорид меди является зеленовато-голубым веществом, которое обладает кристаллической структурой. Он обладает высокой стабильностью и может быть использован в различных химических и промышленных процессах.
Реакция образования гидрохлорида
В результате реакции соляной кислоты с медью образуется гидрохлорид меди, или медный(II) хлорид (CuCl2).
Реакция происходит в соответствии с уравнением:
Cu + 2HCl → CuCl2 + H2↑
Вещество CuCl2 является структурным компонентом ряда важных соединений меди, таких как медные соли, комплексные соединения и катализаторы.
Гидрохлорид меди обладает характерными свойствами, такими как зеленовато-желтый цвет и растворимость в воде. Он также обладает высокой степенью токсичности и обычно используется в лаборатории и в промышленности для различных химических процессов и синтеза соединений меди.
Важно отметить, что реакция образования гидрохлорида меди является экзотермической, то есть сопровождается выделением тепла. Это связано с уменьшением энергетической стабильности и перераспределением энергии в реагирующих веществах.
Разрушение структуры меди
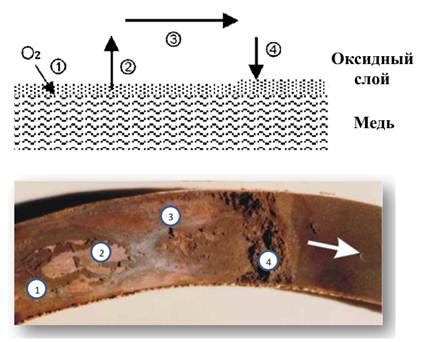
Одной из основных причин разрушения структуры меди является образование хлорида меди (II). В ходе реакции соляной кислоты с медью образуется ион хлорида, который может проникать в межмолекулярные пространства меди и вызывать ее механическое разрушение. Это происходит из-за химической активности ионов хлорида, которые способны вступать в реакции с поверхностными атомами меди и распадаться на хлор и свободные электроны.
Кроме того, хлорид меди (II) может вызывать коррозию металла. Хлориды являются хорошими проводниками электричества, поэтому при наличии влаги или влажной среды они способны создавать гальванические элементы, что приводит к электрохимической коррозии меди. Это может привести к потере прочности и структурных изменений в меди.
Другим фактором, способствующим разрушению структуры меди, является образование растворимого комплекса меди (II) с хлороводородом. Этот комплекс способствует дальнейшей дезинтеграции меди и ее окислению.
| Причины разрушения структуры меди | Последствия |
|---|---|
| Образование хлорида меди (II) | Механическое разрушение металла |
| Электрохимическая коррозия меди | Потеря прочности и структурные изменения |
| Образование растворимого комплекса меди (II) с хлороводородом | Дезинтеграция меди и ее окисление |
Коррозия и окисление меди при взаимодействии соляной кислоты

Cu + 2HCl → CuCl2 + H2
4CuCl2 + O2 → 2CuCl + 2CuO + 2Cl2
Способность соляной кислоты к реакции с медью обусловлена ее окислительными свойствами. Соляная кислота является сильным окислителем, а медь – хорошим восстановителем. Поэтому медь активно окисляется при взаимодействии с кислотой. Окисление меди приводит к образованию пленки оксида меди на поверхности металла, которая дается характерным зеленоватым оттенком и называется патиной.
Коррозия меди обусловлена и тем, что соляная кислота является электролитом и способствует проведению электрического тока. При взаимодействии с медью, кислота образует диффузные слои окисла на поверхности металла, которые обеспечивают передачу электронов и ионов. Электролитическое разложение приводит к диссоциации меди, а окисление – к образованию окиси меди.
Окисление меди при взаимодействии с соляной кислотой не только приводит к образованию патины, но и снижает прочность и стойкость материала. Коррозия меди может вызывать деформацию и повреждение оборудования и предметов, изготовленных из меди. Поэтому важно принимать меры по защите меди от коррозии, например, покрытием поверхности металла защитными покрытиями или использованием неметаллических материалов.
Потеря электронов медью
Медь входит в ряд напряжений металлов, и она находится выше водорода. Поэтому при контакте с соляной кислотой, медь окисляется и теряет электроны, что приводит к образованию ионов меди II.
Уравнение реакции, описывающей потерю электронов медью, выглядит следующим образом:
2HCl + Cu → CuCl2 + H2
Данное уравнение показывает, что соляная кислота (HCl) реагирует с медью (Cu), образуя хлорид меди (CuCl2) и молекулярный водород (H2). В результате реакции медь окисляется и теряет два электрона, становясь положительным ионом Cu2+, а соляная кислота восстанавливается.
Потеря электронов медью является важным процессом, который может привести к образованию различных соединений меди, а также использоваться в промышленности для получения других веществ.
Примечание: при оптическом иллюзорном эффекте медные предметы кажутся светлыми, чаще они окрашены в зеленоватый цвет. Это связано с образованием зеленого карбоната меди (CuCO3).
Влияние концентрации соляной кислоты на реакцию

2HCl + Cu → CuCl2 + H2↑
Главное влияние концентрации соляной кислоты на реакцию с медью заключается в скорости реакции и степени окисления меди. Более высокая концентрация соляной кислоты обеспечивает более быструю реакцию и более полное окисление меди.
При более низкой концентрации соляной кислоты реакция может протекать медленно и неполно, что может привести к образованию нежелательных продуктов, таких как огонь горения водорода (H2). Низкая концентрация также может влиять на степень окисления меди, что может вызвать образование менее стабильных соединений.
Важно отметить, что эксперименты с низкой концентрацией соляной кислоты могут потребовать большего времени для достижения реакции и полного окисления меди. Кроме того, низкая концентрация может требовать использования большего количества соляной кислоты для достижения желаемого результата.
Таким образом, концентрация соляной кислоты оказывает существенное влияние на реакцию с медью. Более высокая концентрация обеспечивает более быструю и полную реакцию, а также более стабильные соединения, в то время как низкая концентрация может вызвать медленную и неполную реакцию, а также образование менее стабильных продуктов.
Температурные эффекты при взаимодействии
При взаимодействии соляной кислоты с медью, температура играет важную роль. Изменение температуры может влиять на скорость реакции и характер процесса.
При повышении температуры скорость реакции между соляной кислотой и медью обычно увеличивается. Это связано с тем, что при повышении температуры молекулы обеих веществ получают больше энергии, что способствует увеличению числа столкновений и, соответственно, ускорению реакции.
Однако существуют исключения из этого правила. Например, при очень высоких температурах может происходить обратная реакция, при которой медь и сольная кислота разлагаются на более простые вещества. Также при очень низких температурах реакция может проходить медленно или вовсе не запускаться.
Температурные эффекты при взаимодействии соляной кислоты с медью могут иметь практическое применение. Например, контроль температуры при производстве или синтезе различных веществ позволяет регулировать скорость реакций и получать нужные продукты с нужными свойствами.
Проблема образования токсичных испарений
Хлороводород (соляная кислота) является ядовитым газом, который обладает резким запахом и очень опасен для дыхательной системы. В высоких концентрациях он может вызывать ожоги слизистых оболочек, причинять повреждения дыхательных путей, вызывать задыхание и даже летальный исход.
Газообразный меди хлорид также является токсичным. При вдыхании он оказывает раздражающее воздействие на дыхательные пути и может вызывать кашель, затруднение дыхания и другие проблемы с дыханием.
Образование этих токсичных испарений является серьезной проблемой при работе с соляной кислотой и медью, особенно в неподходящих условиях, таких как недостаточная вентиляция или закрытое помещение. Кроме того, выделяющиеся испарения могут коррозировать окружающие поверхности и оборудование, что также является негативным аспектом.
Для предотвращения образования токсичных испарений рекомендуется использовать соляную кислоту и медь в хорошо проветриваемых помещениях, а также применять соответствующие средства индивидуальной защиты, например, маску и респиратор.
| Проблема | Причины | Решения |
|---|---|---|
| Образование токсичных испарений | Реакция между соляной кислотой и медью | Использование хорошей вентиляции, индивидуальной защиты |
| Коррозия поверхностей и оборудования | Выделяющиеся испарения | Польза соответствующих покрытий, материалов |
Возможные меры предосторожности при работе с реакцией
- Носите защитные очки и перчатки.
- Работайте в хорошо проветриваемом помещении или под вытяжкой.
- Избегайте попадания соляной кислоты на кожу и в глаза.
- При случайном попадании кислоты на кожу, немедленно промойте область водой в течение нескольких минут.
- При попадании кислоты в глаза, промывайте их в течение 15 минут под проточной водой и немедленно обратитесь к врачу.
- Работайте с кислотой только в специально оборудованной лаборатории или под руководством опытного специалиста.
- Храните кислоту в плотно закрытой емкости, отдельно от других химических веществ.
- Не допускайте контакта кислоты с огнем или нагретыми поверхностями.
- После окончания работы тщательно промойте все использованные материалы и поверхности водой.
Соблюдение этих мер предосторожности поможет минимизировать риски и обеспечить безопасную работу с реакцией соляной кислоты и медью.



