Оксиды - это химические соединения, состоящие из атомов кислорода и других элементов. Они могут быть кислотными, основными или амфотерными, в зависимости от своей реакционной способности. Когда оксиды вступают во взаимодействие с водой, они могут проявлять себя по-разному.
Кислотные оксиды растворяются в воде, образуя кислоту. Например, оксид серы реагирует с водой, образуя серную кислоту. Основные оксиды, например, оксид натрия или оксид кальция, растворяются в воде, образуя щелочные растворы.
Однако амфотерные оксиды - это особый тип оксидов, которые не проявляют ни кислотные, ни щелочные свойства, путем растворения в воде. Они остаются инертными и не вступают в химическую реакцию с молекулами воды. Термин "амфотерный" обозначает способность данных оксидов реагировать как с кислотными, так и с щелочными соединениями в других условиях, но не с водой.
Почему же амфотерные оксиды не реагируют с водой? Ответ кроется в строении и свойствах этих веществ. Амфотерные оксиды обладают структурой, которая не способствует растворению в воде и вступлению в реакцию с молекулами воды. Такие оксиды имеют достаточно сильную химическую связь, которая сопротивляется растворению в воде и образованию ионов, необходимых для реакции. В то же время, они способны взаимодействовать с кислотами и щелочами в более агрессивных химических условиях.
Амфотерные оксиды и их свойства

В кислотной среде амфотерные оксиды могут проявлять свойства оснований и образовывать соли. Например, оксид алюминия (Al2O3) взаимодействует с кислотой и образует алюминат натрия (NaAlO2). Такая реакция иллюстрирует способность амфотерных оксидов проявлять свойства оснований.
В то же время, в щелочной среде амфотерные оксиды могут проявлять свойства кислот и образовывать соли. Например, оксид цинка (ZnO) реагирует с гидроксидом натрия (NaOH) и образует натриевиноксит (Na2ZnO2), что является примером взаимодействия амфотерного оксида с основанием.
Однако, амфотерные оксиды не реагируют с водой. Это объясняется тем, что реакция амфотерного оксида с водой требует наличия или кислоты или основания в реагенте. Вода является нейтральной средой и не обладает такими свойствами, чтобы вызвать реакцию с амфотерными оксидами.
Таким образом, важно отметить, что амфотерные оксиды обладают уникальными свойствами и могут проявляться как кислоты, так и основания, но они не реагируют с водой, так как она является нейтральной средой.
Химическая природа амфотерных оксидов

Основная причина, по которой амфотерные оксиды не реагируют с водой, заключается в их структуре и электрохимических свойствах. Амфотерные оксиды обычно состоят из металлических и неметаллических элементов, имеющих разные электроотрицательности.
Электроотрицательность - это химический параметр, который определяет способность атома притягивать электроны в химической связи. Металлы обычно имеют низкую электроотрицательность, в то время как неметаллы имеют высокую электроотрицательность.
Из-за низкой электроотрицательности металлов, амфотерные оксиды образуют основания, реагируя с кислотами. В такой реакции металлический элемент оксида выступает в роли основания, принимая протон от кислоты. Это одно из основных свойств амфотерных оксидов.
Однако, когда речь идет о реакции амфотерных оксидов с водой, происходит некоторое затруднение. Вода является нейтральным веществом со средней электроотрицательностью, и поэтому не вызывает активного взаимодействия с металлическим элементом оксида. В результате, амфотерные оксиды обычно не реагируют с водой.
Вместо этого, амфотерные оксиды могут вступать в реакцию с кислотами или щелочами, где они выступают либо в роли оснований, либо в роли кислоты, в зависимости от pH раствора. Когда раствор серой кислоты очень разбавлен, оксид серы (IV) реагирует с ней, образуя сульфит, однако в концентрированных растворах серной кислоты (особенно при нагревании), амфотерный оксид гидратируется и растворяется, образуя сульфат этого металла, при этом серная кислота тоже образуется. Вещество, способное снижать выраженность окислительно-восстановительных реакций, свойство амфотерных ее оксидов.
Реактивность амфотерных оксидов

Однако, несмотря на свою амфотерную природу, амфотерные оксиды не реагируют с водой. Это связано с их устойчивостью и низкой активностью в отношении воды.
Водорастворимые амфотерные оксиды могут проявлять свои амфотерные свойства только при взаимодействии с другими соединениями. Например, медный оксид (CuO) является амфотерным оксидом, но его реактивность проявляется в основных или кислотных средах, а не с водой.
Обычно амфотерные оксиды реагируют с кислотами, образуя соли, и с щелочами, образуя гидроксиды металлов. Эти реакции происходят в других растворителях, таких как кислоты или основания, и не требуют воды в качестве реактива.
Таким образом, амфотерные оксиды обычно не реагируют с водой, но способны взаимодействовать с другими соединениями, проявляя свою амфотерность в необходимых условиях.
Взаимодействие амфотерных оксидов с различными кислотами

В отличие от реакции с водой, амфотерные оксиды могут реагировать с различными кислотами и образовывать соли и воду. Это связано с тем, что амфотерные оксиды обладают как щелочными, так и кислотными свойствами.
При взаимодействии амфотерных оксидов с кислотами происходит образование соли и воды. Реакция протекает по следующему механизму: амфотерный оксид и кислота расщепляются на ионы, которые далее соединяются, образуя соль. Водообразование происходит вследствие реакции кислотного и щелочного ионов.
Примером такой реакции может служить взаимодействие амфотерного оксида оксида алюминия (Al2O3) с соляной кислотой (HCl):
- Al2O3 + 6HCl → 2AlCl3 + 3H2O
Таким образом, взаимодействие амфотерных оксидов с различными кислотами позволяет образовывать соли и воду, что является типичным для щелочной реакции.
Поведение амфотерных оксидов при взаимодействии с щелочами
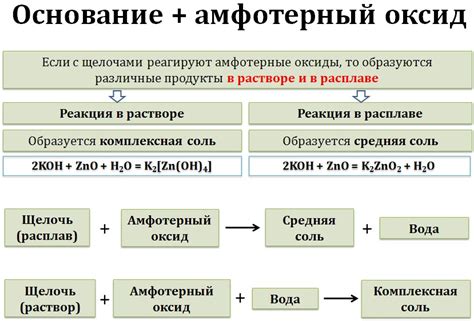
Во-первых, некоторые амфотерные оксиды могут образовывать гидроксиды, которые растворяются в щелочных растворах. Например, оксид алюминия (Al2O3) при взаимодействии с щелочью образует гидроксид алюминия (Al(OH)3), который полностью растворяется в растворе щелочи.
Во-вторых, некоторые амфотерные оксиды образуют нестабильные гидроксиды, которые могут осаждаться в виде нерастворимых осадков. Например, оксид цинка (ZnO) при взаимодействии с щелочью образует гидроксид цинка (Zn(OH)2), который не полностью растворяется и может осаждаться в виде нерастворимых частиц.
Таким образом, поведение амфотерных оксидов при взаимодействии с щелочами зависит от их способности образовывать стабильные гидроксиды или образовывать нестабильные осадки. Такие реакции имеют важное значение в химической промышленности и лабораторных исследованиях.
Особенности реакции амфотерных оксидов с водой

Основная причина этого заключается в том, что реакция между амфотерными оксидами и водой имеет низкую скорость и происходит в очень малых количествах. В результате таких реакций образуются слабые кислоты и щелочи, которые сразу же ионизируются и начинают участвовать в других химических процессах, не давая полноценной реакции с водой.
Более того, амфотерные оксиды обладают высокой устойчивостью к воздействию воды, что делает их малореактивными в этом отношении. Они растворяются в воде очень медленно и образуют сложные ионы, которые не способны проявить свои амфотерные свойства в реакции с водой. Это свойство амфотерных оксидов также связано с наличием у этих веществ сильных связей и структурных особенностей, которые затрудняют взаимодействие с водой.
Таким образом, особенности реакции амфотерных оксидов с водой связаны с их низкой реактивностью и устойчивостью к этому веществу. Несмотря на то, что амфотерные оксиды могут проявлять кислотные и щелочные свойства в других реакциях, они не вступают в существенную реакцию с водой.
Практическое применение амфотерных оксидов

Амфотерные оксиды представляют собой вещества, которые могут реагировать и с кислотами, и с щелочами. Такое свойство делает их полезными в различных областях науки и промышленности. Вот некоторые примеры практического применения амфотерных оксидов:
- Производство стекла: Амфотерные оксиды, такие как оксид алюминия (Al2O3), используются в процессе производства стекла. Они добавляются в сырьевой состав стекловаренных масс для контроля pH и получения требуемых свойств стекла.
- Электродное покрытие: Некоторые амфотерные оксиды, например оксид циркония (ZrO2), обладают высокой коррозионной стойкостью и могут использоваться для электродного покрытия различных металлических поверхностей.
- Катализ: Амфотерные оксиды часто используются в качестве катализаторов в различных химических реакциях. Например, оксид алюминия может использоваться в процессе гидрооксигидрирования, а оксид меди (CuO) - в процессе окисления водорода.
- Очистка воды: Некоторые амфотерные оксиды, например оксид железа (Fe2O3), могут использоваться для удаления различных загрязнений из воды. Они обладают способностью связывать и осаждать различные тяжелые металлы и другие загрязнители.
- Производство косметических и фармацевтических продуктов: Некоторые амфотерные оксиды, такие как оксид цинка (ZnO), нашли применение в производстве косметических и фармацевтических продуктов. Они могут использоваться в качестве солнцезащитных фильтров и антибактериальных средств.
Таким образом, амфотерные оксиды являются универсальными веществами, которые находят применение во многих отраслях промышленности и научных исследований. Их способность реагировать как с кислотами, так и с щелочами делает их ценными компонентами в различных процессах и технологиях.



