Медь - благородный металл, известный своей высокой электропроводностью и превосходным термическим проводником. Однако, несмотря на свои многочисленные полезные свойства, медь не растворяется в соляной кислоте. Этот факт заставляет задуматься и исследовать причины такого поведения.
Соляная кислота, также известная как хлороводородная кислота, является кислотным раствором, образующимся при растворении хлористоводородного газа (HCl) в воде. Она обладает сильно кислыми свойствами и широко используется в науке и промышленности. Однако, несмотря на свою кислотность, соляная кислота не обладает способностью растворять медь.
Главной причиной такого поведения меди в присутствии соляной кислоты является ее высокая устойчивость к окислению. Медь образует плотную оксидную пленку на своей поверхности, которая защищает металл от реакции с кислотой. Эта пленка состоит из основного оксида меди (Cu2O) или основного гидроксида меди (Cu(OH)2), которые создают непроницаемый барьер между металлом и кислотой.
Причины, по которым медь не растворяется в соляной кислоте

- Образование пассивной пленки: при контакте с соляной кислотой, на поверхности меди образуется тонкая пленка, состоящая из несмываемых оксидов и хлоридов меди. Эта пассивная пленка надежно защищает медь от дальнейшего взаимодействия с кислотой.
- Низкое окислительное действие соляной кислоты: соляная кислота не обладает достаточной окислительной активностью, чтобы разрушить пассивную пленку на поверхности меди и растворить ее. Другие кислоты, например, азотная или азотная смесь с серной кислотой, могут эффективно растворять медь.
- Образование солей низкой растворимости: если все-таки происходит некоторое взаимодействие между медью и соляной кислотой, то образующиеся соли меди (хлорид, сульфат и пр.) обладают низкой растворимостью в воде. Это затрудняет процесс растворения меди в соляной кислоте.
Таким образом, химические и физические свойства меди, а также низкая активность соляной кислоты, делают медь практически нерастворимой в этой кислоте.
Низкая реакционная способность меди

Когда медь вступает в контакт с соляной кислотой, она проявляет незначительную активность, поскольку гидроксиды, продукты реакции, являются хорошими защитниками поверхности. Гидроксиды формируются при взаимодействии соляной кислоты с кислородом воздуха. Они охватывают медь и предотвращают её дальнейшую реакцию с кислотой.
Соляная кислота содержит водородные и хлоридные ионы. Эти ионы пытаются вступить в реакцию с поверхностью меди, но гидроксиды, благодаря своему защитному слою, не дают им доступа к металлу.
Таким образом, низкая реакционная способность меди в соляной кислоте обусловлена образованием защитной пленки на поверхности металла.
Образование пассивной оксидной пленки на поверхности

Медь обладает особой способностью образовывать пассивную оксидную пленку на своей поверхности при взаимодействии с окружающей средой. Эта пленка играет важную роль в защите металла от дальнейшего взаимодействия с агрессивными средами, включая соляную кислоту.
Процесс формирования оксидной пленки начинается с реакции меди с кислородом из воздуха или раствора. В результате этой реакции образуется оксид меди (II) CuO, который непосредственно контактирует с окружающей средой и может претерпевать дальнейшие реакции.
Дальнейшее окисление меди приводит к образованию оксида меди (I) Cu2O. Эта стадия является важным этапом формирования пассивной оксидной пленки. Поверхность меди покрывается слоем Cu2O, который защищает металл от дальнейшего окисления и растворения в агрессивных средах, включая соляную кислоту.
Окисление меди до Cu2O является непротекающим процессом при обычных условиях. Это связано с тем, что Cu2O обладает стабильной структурой и свойствами, которые препятствуют дальнейшему окислению. Благодаря пассивной оксидной пленке, медь становится устойчивой к действию соляной кислоты и других кислотных сред.
- Образование оксидной пленки является процессом автокаталитическим, то есть самоускоряющимся.
- Пассивная оксидная пленка на меди имеет кристаллическую структуру и обладает электрическими свойствами, что делает ее эффективным защитным слоем.
- Скорость образования пассивной оксидной пленки может зависеть от условий окружающей среды, например, от концентрации кислоты, температуры и времени воздействия.
Образование пассивной оксидной пленки на поверхности меди является важным физико-химическим процессом, который придает металлу дополнительную стабильность и устойчивость к окислению и растворению в агрессивных средах. Это объясняет, почему медь не растворяется в соляной кислоте и сохраняет свои свойства на протяжении длительного времени.
Стойкость кислоты перед атакой меди

Соляная кислота (HCl) – одна из наиболее распространенных и сильных минеральных кислот, способная растворять и коррозировать множество материалов. Однако медь не растворяется в соляной кислоте под влиянием обычных условий.
Почему же медь столь стойка к атаке соляной кислоты?
Ответ кроется в составе и реакционной способности меди.
Медь обладает слабой окислительной способностью, что означает, что она не может окислять другие вещества сильнее себя. В соляной кислоте, присутствие Cl-ионов создает окислительную среду, и медь не имеет возможности проявить свою реактивность.
Кроме того, поверхность меди покрывается защитной пленкой оксида меди (CuO). Эта пленка не растворяется в соляной кислоте, что предотвращает дальнейшую атаку на металл. При этом пленка оксида меди может образовываться самостоятельно при взаимодействии меди с кислородом из воздуха.
Таким образом, медь стойка к атаке соляной кислоты благодаря своей слабой окислительной способности и наличию защитной пленки оксида меди на поверхности.
Сильное окислительное свойство кислоты
Медь (Cu) - хороший проводник электричества и тепла. В медной поверхности находятся свободные электроны, которые способны передвигаться и создавать электрический ток. Однако, соляная кислота не способна растворить медь из-за ее сильного окислительного действия.
| Реакция | Уравнение |
|---|---|
| Медь + соляная кислота | Cu + 2HCl → CuCl2 + H2 |
Когда медь реагирует с соляной кислотой, происходит образование хлорида меди (CuCl2) и выделение водорода (H2). Однако реакция идет медленно, поскольку соляная кислота не может легко отнять электроны от меди.
На поверхности меди образуется плотная защитная пленка - оксид меди (CuO), которая предотвращает дальнейшую реакцию меди с соляной кислотой. Эта пленка является причиной того, почему медь не растворяется в соляной кислоте.
Отсутствие соединений меди с хлором в данной реакции

За исключением небольшой реакции на поверхности меди, с помощью соляной кислоты, медь не растворяется в HCl, и этот факт привлекает внимание исследователей. Это связано с особыми свойствами меди и химической природой соляной кислоты.
Медь - довольно инертный металл, и его поверхность скорее реагирует с кислородом из воздуха, образуя тонкую пленку оксида и гидроксида меди. Эта пленка обладает защитными свойствами, предотвращая дальнейшую реакцию меди с соляной кислотой.
Соляная кислота, в свою очередь, является довольно агрессивным растворителем, способным реагировать с большим количеством веществ. Однако, хлорид меди (CuCl) не стабилен в этом средстве и быстро разлагается, образуя дополнительные реакционные продукты. В результате этот процесс предотвращает образование устойчивой реакции растворения меди в соляной кислоте.
| HCl | Cu | CuCl |
|---|---|---|
| Соляная кислота | Медь | Хлорид меди |
| Реагирует | Не реагирует | Разлагается |
В результате, медь не растворяется в соляной кислоте и не образует соединений с хлором в данной реакции.
Два конкурирующих процесса в реакции

Когда медь оказывается в контакте с соляной кислотой, происходят два важных процесса, которые конкурируют друг с другом. Эти процессы определяют результат реакции и объясняют, почему медь не растворяется в соляной кислоте.
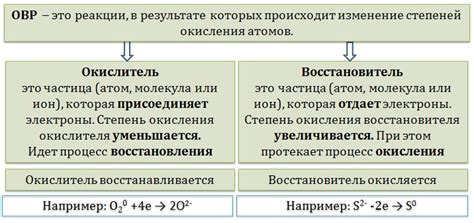
- Реакция окисления: Соляная кислота обладает окислительными свойствами, поэтому она стремится окислить медь и извлечь из нее электроны. В результате этой реакции медь превращается в ионы меди с положительным зарядом (Cu2+). Этот процесс является начальным этапом реакции.
- Защитная реакция: Однако, когда медь окисляется и образует ионы меди, они немедленно соединяются с хлоридными ионами из соляной кислоты, образуя нерастворимое вещество - хлорид меди (CuCl2). Это происходит из-за того, что растворимость хлорида меди очень низкая. Образовавшийся хлорид меди образует тонкую защитную пленку на поверхности меди, которая предотвращает дальнейшее взаимодействие с соляной кислотой.
Таким образом, реакция окисления и защитная реакция на поверхности меди происходят практически одновременно. Однако, защитная реакция эффективна в предотвращении полного растворения меди в соляной кислоте. Благодаря защитной пленке, медь сохраняет свою структуру и свойства, что объясняет ее устойчивость к растворению в данной кислоте.
Реакционная способность продуктов реакции

Взаимодействие меди и соляной кислоты приводит к образованию хлорида меди(II) и выделению водорода. Реакция можно описать следующим образом:
2HCl + Cu → CuCl2 + H2
Продуктами реакции являются хлорид меди(II) и молекулы водорода. Хлорид меди(II) имеет формулу CuCl2 и представляет собой соль, состоящую из ионов меди(II) и хлорида. Водород же является газом, который выделяется при реакции в результате окислительно-восстановительных процессов.
Реакционная способность продуктов реакции определяется их структурой и химическими свойствами. Хлорид меди(II) обладает реакционной способностью, при которой может образовывать соединения с другими веществами. В случае с медью, хлорид меди(II) образуется благодаря его реакционной способности с соляной кислотой.
Однако, медь сама по себе обладает низкой реакционной способностью в соляной кислоте. Это связано с тем, что медь является достаточно инертным металлом и покрыта тонким слоем оксида, который защищает ее от дальнейшего взаимодействия с кислотами. Таким образом, медь не растворяется в соляной кислоте и не образует продуктов реакции с ней.
Такое поведение меди обусловлено ее положением в ряде активности металлов. Медь расположена ниже водорода в этом ряду, что означает, что она менее реакционноспособна по сравнению с ним. Таким образом, медь не может вытеснить водород из соляной кислоты и не растворяется в ней.
Особенности электрохимической природы меди

Медь представляет собой хороший проводник электричества, благодаря своей высокой проводимости. В растворе медь может находиться в двух основных формах - в ионной форме (Cu2+) и в нейтральном состоянии (Cu°). Окислительное воздействие соляной кислоты может приводить к окислению нейтральной меди в ионную форму:
- Cu° → Cu2+ + 2e-
Таким образом, медь может быть окислена в соляной кислоте, однако этот процесс происходит медленно и не приводит к полному растворению меди.
Для полного растворения меди в соляной кислоте требуется более энергичное окислительное вещество, например концентрированный азотнокислый растворитель. В таком растворителе происходит полное окисление меди в ионную форму:
- Cu° → Cu2+ + 2e-
Таким образом, основной причиной нерастворимости меди в соляной кислоте является недостаточная энергия окислительного воздействия этого кислотного раствора.
Это свойство меди делает ее ценным материалом для использования в различных отраслях промышленности, включая электротехнику, строительство и производство монет. Благодаря своей устойчивости к коррозии, медь может использоваться в агрессивных средах, где другие металлы быстро разрушаются.



