Замерзание соленой воды - явление, которое может показаться необычным и странным. Действительно, каким образом соленая вода может медленно замерзать по сравнению с пресной? В этой статье мы попытаемся найти научное объяснение этому явлению и разобраться, какие факторы влияют на его причину.
Соленая вода содержит определенное количество растворенных солей, таких как натрий, калий и хлориды. Когда мы понижаем температуру воды, эти соли начинают формировать кристаллическую структуру, которая препятствует полному замерзанию воды.
Одной из основных причин замедленного замерзания соленой воды является понижение точки замерзания. Растворение солей в воде приводит к понижению температуры замерзания, поскольку ионы солей разрушают связи между молекулами воды. Это означает, что для замерзания соленой воды потребуется более низкая температура по сравнению с пресной водой.
Другой причиной является образование ледяной оболочки. Когда соленая вода начинает замерзать, соли с концентрированной водой остаются в жидкой фазе, образуя ледяные кристаллы на поверхности. Эта ледяная оболочка защищает более глубокие слои воды от дальнейшего охлаждения и замерзания.
Важно отметить, что хотя замедленное замерзание соленой воды может быть интересным физическим явлением, оно имеет свои практические применения. Например, весьма удобно использовать соленую воду при солевой обработке дорог в зимний период, поскольку она замерзает медленнее и дольше остается жидкой, что помогает предотвратить образование ледяной корки на дорожном покрытии.
Молекулярная структура соли и влияние на замерзание
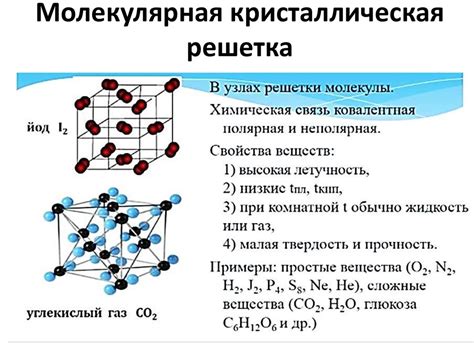
Молекулы соли имеют кристаллическую структуру, в которой положительные и отрицательные ионы располагаются в упорядоченном способе. Эта структура обуславливает множество свойств соли, включая ее способность влиять на процесс замерзания.
Один из существенных факторов, определяющих влияние соли на замерзание, - это снижение температуры замерзания раствора. Молекулы соли вступают во взаимодействие с молекулами воды, формируя гидратные оболочки вокруг самих солей. Это приводит к изменению свойств воды, включая температуру замерзания.
Если раствор содержит ионы соли, то они препятствуют образованию кристаллической структуры льда. Ионы соли встраиваются в кристаллическую решетку льда и нарушают ее упорядочение, затрудняя процесс замерзания. Таким образом, соленые растворы замерзают с меньшей скоростью, чем чистая вода.
Однако, важно отметить, что на определенных концентрациях солей, процесс замерзания может замедляться в меньшей степени или даже иногда ускоряться. Это связано с изменением количества гидратных оболочек, образовываемых вокруг ионов соли, в зависимости от их концентрации в растворе.
- Молекулярная структура солей
- Кристаллическая решетка
- Изменение свойств воды
- Препятствие образованию кристаллической структуры льда
- Замедление процесса замерзания
- Изменение скорости замерзания в зависимости от концентрации солей
Гранулометрический состав соли и его влияние на процесс замерзания
Гранулометрический состав соли относится к размеру частиц вещества, из которых она состоит. Этот параметр имеет важное значение при анализе процесса замерзания соленой воды. Размер частиц соли определяет степень и скорость ее растворения в воде, а также влияет на плотность и вязкость полученного раствора.
Очевидно, что чем меньше размер частиц соли, тем больше поверхности взаимодействия между солью и водой. Это приводит к более интенсивному процессу растворения соли, так как вода может проникать во все мельчайшие поры и трещины между частицами.
Поэтому, соли с более мелким гранулометрическим составом быстрее растворяются в воде и создают более концентрированный раствор. Это означает, что соленая вода с мелкой солью будет иметь более низкую температуру замерзания по сравнению с соленой водой с крупной солью.
Кроме того, гранулометрический состав соли оказывает влияние на физические свойства полученного раствора и, соответственно, на процесс замерзания. Чем мельче соль, тем выше будет вязкость раствора и, как следствие, ниже скорость его замерзания.
Таким образом, гранулометрический состав соли играет важную роль в процессе замерзания соленой воды. Размер частиц соли определяет скорость растворения, концентрацию раствора и скорость его замерзания. Данная информация является важной для понимания механизмов и причин замедленного замерзания соленой воды.
Растворимость соли и ее связь с замедленным замерзанием
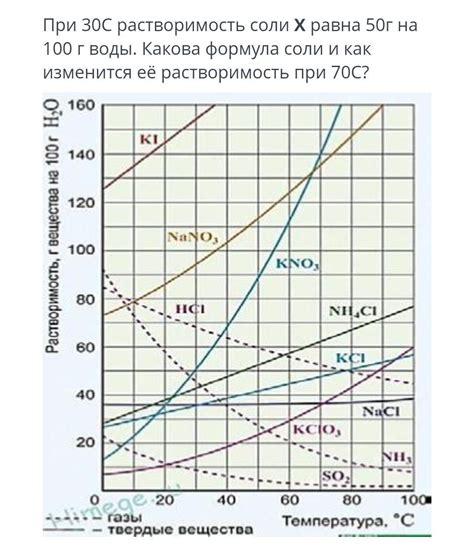
Растворимость соли играет важную роль в процессе замедленного замерзания соленой воды. Водные растворы солей, таких как хлорид натрия (NaCl), обладают свойством понижать точку замерзания воды. Это означает, что соленая вода начнет замерзать при более низкой температуре, чем чистая вода.
Растворимость соли определяется концентрацией соли в растворе и температурой. При низких температурах соли растворяются в воде в меньших количествах, а при повышении температуры растворимость возрастает. Таким образом, при замедленном замерзании соленой воды, соли медленно выделяются из раствора, образуя аномально теплопроводную среду вблизи ледяных пластинок.
| Температура (°C) | Концентрация соли (%) |
|---|---|
| -2 | 10 |
| -5 | 20 |
| -10 | 30 |
| -15 | 40 |
| -20 | 50 |
Таблица показывает зависимость концентрации соли от температуры в соленой воде. Чем выше концентрация соли, тем ниже точка замерзания воды. Например, при -10 °C соленая вода с концентрацией 30% не замерзнет, в отличие от чистой воды.
Это явление можно наблюдать на практике, например, на дорогах, которые посыпают солью в зимний период. Соль помогает предотвратить образование льда и обледенения, замедляя процесс замерзания воды на дорожном покрытии.
Таким образом, растворимость соли в воде и ее влияние на точку замерзания объясняют механизм замедленного замерзания соленой воды. Это явление широко используется в различных областях, включая химическую промышленность, метеорологию и дорожное строительство.
Химические реакции, влияющие на криоскопический эффект

Криоскопический эффект представляет собой снижение точки замерзания раствора по сравнению с точкой замерзания чистого растворителя. Это явление очень важно в биологии, медицине и промышленности. Химические реакции могут влиять на криоскопический эффект, изменяя свойства раствора и его точку замерзания.
Одной из основных химических реакций, влияющих на криоскопический эффект, является ионизация соли. Когда соль растворяется в воде, она распадается на положительно и отрицательно заряженные ионы. Эти ионы, взаимодействуя с молекулами воды, изменяют их свойства и замедляют процесс замерзания.
Кроме ионизации, химические реакции могут также влиять на криоскопический эффект через образование сложных соединений. Например, некоторые растворы солей, кислот и оснований могут образовывать комплексы с водой, что приводит к изменению точки замерзания раствора.
Другой важной химической реакцией, влияющей на криоскопический эффект, является диссоциация. Растворы сильных электролитов, таких как соляная кислота или серная кислота, диссоциируют на ионы с большим количеством частиц. Это приводит к более сильному снижению точки замерзания, чем в растворах слабых электролитов.
Таким образом, химические реакции играют важную роль в криоскопическом эффекте, определяя его интенсивность и характер изменения точки замерзания раствора. Изучение этих реакций позволяет лучше понять физико-химические свойства растворов и их взаимодействие с окружающей средой.
Влияние окружающей среды на скорость замерзания соли

Кроме того, атмосферное давление оказывает влияние на скорость замерзания. При высоком атмосферном давлении плотность воды увеличивается, что приводит к более медленному замерзанию. Наоборот, при низком атмосферном давлении вода замерзает быстрее. Это объясняется тем, что при низком давлении парциальное давление водяного пара над водой становится выше и происходит интенсивное испарение, сопровождающееся потерей тепла и замерзанием.
Также стоит отметить, что определенные физические свойства окружающей среды, такие как турбулентность потока воздуха или движение воды, могут влиять на скорость замерзания соли. Например, при наличии сильного ветра или потока воды, замерзание может происходить быстрее из-за увеличенной конвекции тепла с поверхности воды.
Практические применения замедленного замерзания соленой воды

Замедленное замерзание соленой воды имеет множество практических применений в различных областях науки и технологии. Вот некоторые из них:
1. Ледоставление на дорогах: Замерзание соленой воды происходит с меньшей скоростью, чем замерзание обычной воды. Это позволяет использовать соленую воду для посыпки дорог и тротуаров и предотвращать образование гололедицы.
2. Криобиология: Замедленное замерзание соленой воды используется в криобиологии для сохранения организмов, органов и тканей при низких температурах. Соленая вода помогает защитить элементы клеток от повреждений, связанных с образованием льда, и сохраняет их структуру и функции.
3. Медицинская промышленность: Замерзание соленой воды используется при замораживании тканей для биопсии и для проведения криохирургических операций. Это позволяет точно местно охлаждать и замораживать проблемные области, минимизируя повреждение окружающих тканей.
4. Производство пищевых продуктов: Замедленное замерзание соленой воды применяется в пищевой промышленности для замораживания продуктов, сохраняя их вкус, питательные качества и текстуру.
5. Энергетика и электроника: Замерзание соленой воды с меньшей скоростью может быть использовано для охлаждения компонентов в различных системах, таких как электронные устройства, ядерные реакторы и оборудование энергетических установок.
Замедленное замерзание соленой воды имеет широкий спектр применений, и его изучение продолжается для разработки новых технологий и инноваций в различных отраслях науки и промышленности.



