Металлы - это элементы, которые проявляют свои характеристики благодаря своей способности образовывать катионы, то есть положительно заряженные ионы. Один из способов проявления такой способности - образование положительных степеней окисления.
Положительные степени окисления металлов могут возникать из-за потери электронов. Этот процесс называется окислением. Когда металл теряет одни или несколько электронов, он превращается в катион с положительной зарядой.
Основная причина образования положительных степеней окисления заключается в стремлении металлов достичь определенной стабильности. Возможность образования катионов позволяет металлам сократить свою энергию, так как в ионном виде они обладают более устойчивой структурой и меньшей энергией окисления по сравнению с атомами.
Кроме того, положительные степени окисления металлов имеют важное практическое значение. Они позволяют металлам образовывать соединения с другими элементами, такими как неметаллы или другие металлы, и принимать участие в различных химических реакциях. Это делает металлы важными ингредиентами в различных промышленных процессах и позволяет им проявлять свои уникальные свойства в различных областях науки и техники.
Что такое положительные степени окисления?
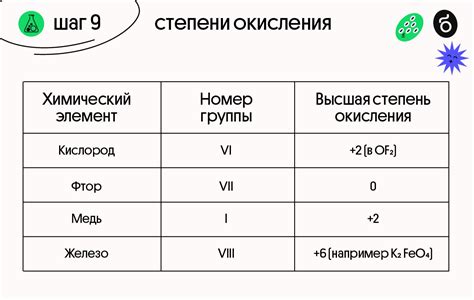
Положительные степени окисления обычно обозначаются арабскими цифрами с плюсом, например +2, +3 и т.д. Чем выше положительная степень окисления металла, тем больше электронов он потерял и тем более активен он становится.
Положительные степени окисления имеют важное значение при определении химических формул и названий соединений, а также при проведении химических реакций. Они помогают определить, какие элементы в соединении являются катионами (положительно заряженными ионами) и какие анионами (отрицательно заряженными ионами).
Положительные степени окисления металлов обусловлены такими факторами, как электроотрицательность металла, его электронная конфигурация и окружение элементов в соединении. Например, металлы с меньшей электроотрицательностью и более низкой электронной конфигурацией имеют более высокие положительные степени окисления.
Знание положительных степеней окисления металлов позволяет предсказывать их реакционную способность и взаимодействие с другими веществами, а также использовать их в различных промышленных и научных процессах.
Причины положительных степеней окисления
Положительная степень окисления металлов обусловлена особыми химическими свойствами этих элементов, а также их взаимодействием с другими веществами.
Одной из причин положительных степеней окисления металлов является их способность вступать в химические реакции с негативно заряженными частицами, такими как анионы. В результате таких реакций металлы могут передавать свои электроны анионам, что приводит к образованию оксидов или ионных соединений.
Другой причиной положительных степеней окисления металлов является их электронная конфигурация. Металлы обычно имеют главные квантовые числа, сопоставляемые с периодической системой химических элементов. В этих числах заключается основная особенность электронного строения металлов, определяющая их химические свойства. Периодическая система учитывает их электронную конфигурацию, что объясняет, почему некоторые металлы имеют положительные степени окисления, тогда как другие металлы могут иметь только отрицательные степени окисления.
Также, положительная степень окисления металлов может быть обусловлена их атомным радиусом. Металлы с более компактной структурой имеют больший тяготение к потере электронов, что приводит к положительным степеням окисления. Большинство металлов в периодической системе имеют маленький атомный размер по сравнению с не-металлами, что также влияет на их способность образовывать положительные степени окисления.
Таким образом, положительные степени окисления металлов обусловлены их химическими свойствами, электронной конфигурацией и атомным радиусом. Понимание этих причин помогает в объяснении и предсказании химических реакций металлов и их взаимодействия с другими веществами.
Уровень энергии электронов в атоме
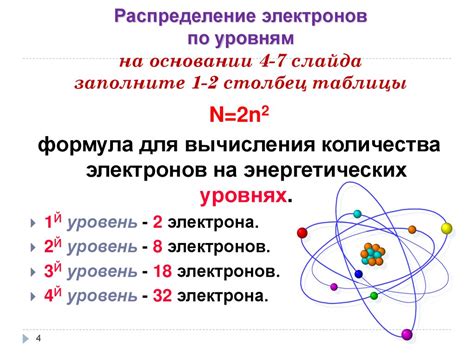
Уровни энергии электронов в атоме описываются квантовой механикой и соответствуют различным энергетическим состояниям электронов вокруг ядра. Эти уровни образуют электронные оболочки, которые могут содержать различное количество электронов. Относительное заполнение электронных оболочек определяет электронную конфигурацию атома.
Металлические элементы, чьи атомы имеют большую энергию и малое количество электронов в внешней электронной оболочке, имеют большую склонность к потере электронов и положительным степеням окисления. Это обусловлено тем, что атомы металла могут легко отдавать электроны и образовывать положительные ионы. Например, наиболее распространенная степень окисления железа +2 обусловлена потерей двух электронов из внешней оболочки.
С другой стороны, неметаллические элементы, чьи атомы имеют большую энергию и большое количество электронов в внешней электронной оболочке, имеют большую склонность к получению электронов и отрицательным степеням окисления. Например, кислород имеет степень окисления -2, так как он образует двойные связи с другими атомами, принимая от них два электрона и заполняя свою внешнюю электронную оболочку.
Электроотрицательность и положительные степени окисления

Положительные степени окисления металлов связаны с их склонностью отдавать электроны другим атомам. Это обуславливается тем, что атомы металлов обычно имеют малую электроотрицательность, поэтому они слабо притягивают электроны и легко отдают их другим атомам, электроотрицательность которых больше.
Таким образом, металлы с меньшими значениями электроотрицательности имеют больший потенциал отдавать электроны и могут иметь более высокие положительные степени окисления. Например, металлы в первой группе периодической системы (например, литий) имеют наименьшие значения электроотрицательности и могут иметь самые высокие положительные степени окисления.
Однако, не все металлы имеют только положительные степени окисления. Многие металлы могут иметь несколько степеней окисления в зависимости от условий реакции. Например, железо может образовывать соединения с положительными степенями окисления +2 и +3.
Итак, электроотрицательность является одной из основных причин и объяснений положительных степеней окисления металлов. Металлы с меньшей электроотрицательностью имеют большую склонность отдавать электроны и, следовательно, могут иметь более высокие положительные степени окисления.
Объяснения положительных степеней окисления

Образование ионов металла
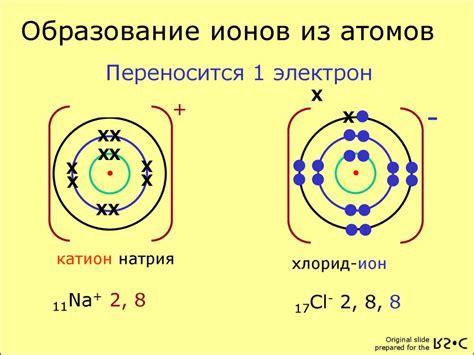
Ионы металлов образуются в результате перехода электронов от металла к не металлу в химических реакциях. Металлы, как правило, обладают низкими электроотрицательностями, что позволяет им отдавать электроны и образовывать положительные ионы.
Образование ионов металла может происходить путем потери одного или нескольких электронов. Количество электронов, которые металл отдает, определяет его положительную степень окисления. Например, железо может образовывать ионы Fe^2+ и Fe^3+, потеряв два и три электрона соответственно.
При образовании ионов металла происходит окислительно-восстановительная реакция. Металл окисляется, отдавая электроны, которые принимает не металл, в результате чего образуются ионы. Такой процесс может происходить как в растворе, так и в твердом состоянии.
Образование ионов металла играет важную роль в химических реакциях и химических соединениях. Положительные ионы металлов обладают определенными свойствами и способностию к образованию соединений с отрицательными ионами не металлов.
Электронное строение атома металла

Ядро атома металла состоит из протонов (положительно заряженных частиц) и нейтронов (неполяризующихся частиц). Протоны, взаимодействуя друг с другом через силу электромагнитного притяжения, удерживают нейтроны в ядре.
Электронная оболочка атома металла состоит из электронов (отрицательно заряженных частиц), которые движутся вокруг ядра по орбитальным энергетическим уровням. Внутренние энергетические уровни оболочки металла заполняются электронами в первую очередь, а внешний уровень содержит валентные электроны – электроны, участвующие в химических реакциях.
Количество электронов на внешнем энергетическом уровне атома металла определяет его положительную степень окисления. Когда внешний уровень полностью заполнен электронами, атом нейтрален. Если же на внешнем уровне не хватает электронов для его заполнения до полного восьми электронов, атом приобретает положительную степень окисления, равную числу недостающих электронов.
Например, атом металла железа (Fe) имеет электронную конфигурацию 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁶. Учитывая правило заполнения энергетических уровней, на внешнем уровне атома железа находятся 2 электрона, что соответствует полной валентности и нейтральному заряду атома.
Важно отметить, что положительная степень окисления атомов металлов возникает в процессах химических реакций, когда металл отдает один или несколько своих валентных электронов. Это явление объясняется стремлением атома металла достичь более устойчивого электронного строения за счет образования ионов с положительным зарядом.
Примеры положительных степеней окисления
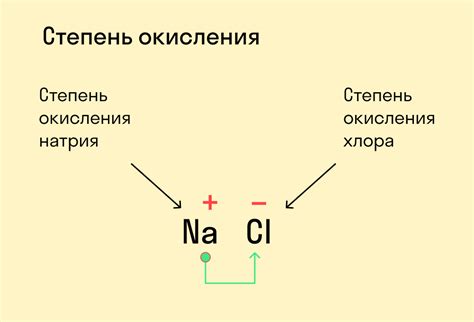
Положительные степени окисления металлов встречаются в различных соединениях и играют важную роль в химических реакциях и синтезе различных соединений.
Ниже приведены несколько примеров металлов с положительными степенями окисления:
- Железо (Fe) может иметь положительные степени окисления +2 и +3. В соединениях с положительной степенью окисления +2 оно образует соединения типа FeO, FeCl2 и FeSO4, а в соединениях с положительной степенью окисления +3 - Fe2O3, FeCl3 и Fe(NO3)3.
- Медь (Cu) может иметь положительные степени окисления +1 и +2. В соединениях с положительной степенью окисления +1 она образует соединения типа Cu2O и CuCl, а в соединениях с положительной степенью окисления +2 - CuO, CuCl2 и CuSO4.
- Свинец (Pb) может иметь положительные степени окисления +2 и +4. В соединениях с положительной степенью окисления +2 он образует соединения типа PbO и PbCl2, а в соединениях с положительной степенью окисления +4 - PbO2 и PbCl4.
- Алюминий (Al) обычно имеет положительную степень окисления +3. Он образует соединения типа Al2O3 и AlCl3.
- Никель (Ni) может иметь положительные степени окисления +2 и +3. В соединениях с положительной степенью окисления +2 он образует соединения типа NiO и NiCl2, а в соединениях с положительной степенью окисления +3 - Ni2O3 и NiCl3.
Это лишь несколько примеров металлов с положительными степенями окисления. Использование положительных степеней окисления металлов позволяет ученым изучать их свойства, проводить различные химические реакции и создавать новые соединения.
Положительные степени окисления металлов первой группы
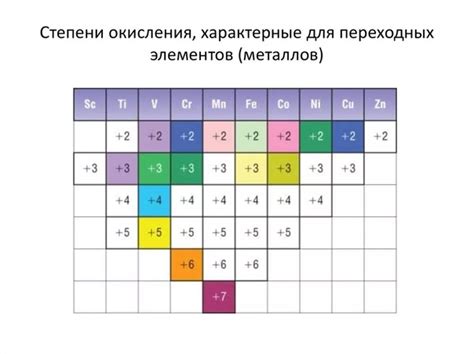
Металлы первой группы периодической системы включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Все эти металлы имеют один валентностный электрон в своей внешней электронной оболочке. Это делает их склонными к потере этого электрона и образованию положительных степеней окисления.
Окисление - это процесс, при котором атом или ион теряет электроны. Атомы металлов первой группы имеют слабую силу удержания своего валентностного электрона, поэтому они легко отделяют его, чтобы стать положительными ионами. Поэтому положительные степени окисления металлов первой группы всегда равны +1.
Как правило, металлы первой группы имеют активный металлический характер и быстро реагируют с другими веществами, особенно с неметаллами. Например, они реагируют с кислородом, хлором и серой, образуя соответствующие оксиды, хлориды и сульфиды.
Положительные степени окисления металлов первой группы могут быть объяснены их электронной конфигурацией и потенциалом ионизации. Фактически, потенциал ионизации металлов первой группы очень низкий, что делает их легко ионизируемыми и способными образовывать положительные ионы.
Положительные степени окисления металлов второй группы
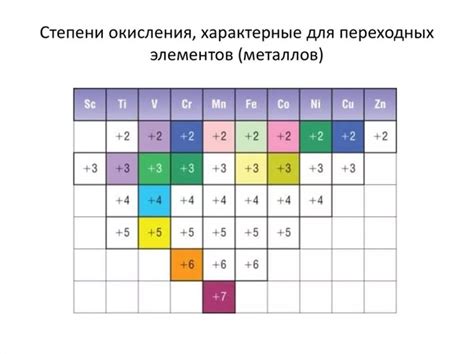
Металлы второй группы периодической системы имеют особенность образования положительных степеней окисления. В этой группе находятся металлы, такие как цинк (Zn), кадмий (Cd) и ртуть (Hg).
Цинк является самым распространенным и хорошо изученным представителем этой группы. Наиболее стабильной степенью окисления для цинка является +2. Это обусловлено его электронной конфигурацией, где у него 2 электрона в валентной оболочке. В соединениях с другими элементами, цинк обычно отдает эти два электрона, образуя ион Zn^2+, который становится стабильным.
Кадмий, находящийся в этой группе, также имеет степень окисления +2. Его электронная конфигурация и свойства подобны цинку. Кадмий способен образовывать стабильные соединения, отдавая два электрона и образуя ион Cd^2+.
Ртуть, наиболее известная металл в группе, имеет две степени окисления: +1 и +2. Степень окисления +2 наиболее распространена и стабильна. Ртуть может образовывать соединения с различными элементами, такими как кислород, сера и галогены, и образует ион Hg^2+. Также ртуть может образовывать стабильные соединения с положительным зарядом +1.
Положительные степени окисления металлов второй группы играют значительную роль в химических реакциях и образовании соединений. Их стабильность и физические свойства делают эти металлы ценными и широко используемыми в различных отраслях промышленности.



