Жиры и вода - две разные сущности, которые имеют различные свойства и взаимодействия. Очевидно, что жиры плохо растворяются в воде, но почему это происходит? Для полного понимания этого процесса требуется анализ структуры молекулы жира.
Молекула жира состоит из трех химических элементов: углерода, водорода и кислорода. Внутри молекулы углеродные и водородные атомы образуют длинную гидрофобную цепочку, а на конце каждой цепочки находится гидрофильная головка, состоящая из кислородного атома.
Удивительное свойство молекулы жира заключается в том, что ее гидрофобная цепочка (неспособность растворяться в воде) и гидрофильная головка (способность растворяться в воде) находятся рядом друг с другом. Из-за этого несоответствия структуры, молекула жира отталкивается от воды и не может раствориться в ней полностью.
Химический состав жиров
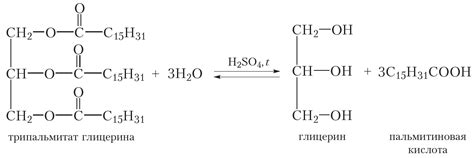
Основными видами жиров являются насыщенные, одно- и многоненасыщенные жиры. Насыщенные жиры содержат только насыщенные жирные кислоты, которые не содержат двойных связей между углеродами. Одноненасыщенные жиры содержат одну двойную связь между углеродами в цепи жирной кислоты, а многоненасыщенные жиры содержат более одной двойной связи.
Химический состав жиров влияет на их свойства и растворимость в различных растворителях, включая воду. Из-за наличия гидрофобных характеристик у жирных кислот, жиры плохо растворяются в воде. Гидрофобные участки молекулы являются неполярными и отталкивают полярные молекулы воды, что делает растворение жиров в воде трудным процессом.
Однако жиры легко растворяются в органических растворителях, таких как этиловый спирт или бензин, которые также являются неполярными. Благодаря этой неполярности, жиры образуют стабильные растворы в таких средах.
Важно помнить: химический состав жиров определяет их свойства и влияет на их растворимость в различных растворителях. Гидрофобные характеристики жирных кислот делают жиры плохо растворимыми в воде, в то время как их хорошая растворимость в органических растворителях обусловлена их неполярностью.
Взаимодействие молекул жиров и воды

Жиры представляют собой группу органических молекул, которые в основном состоят из углеродных и водородных атомов. В отличие от других классов органических соединений, таких как углеводы и белки, жиры имеют гидрофобную природу, что означает, что они плохо растворяются в воде.
Вода, в свою очередь, является полярным растворителем, так как ее молекулы имеют как положительный, так и отрицательный заряд. Это создает водородные связи между молекулами воды, что позволяет им образовывать кластеры и передвигаться в жидком состоянии.
Взаимодействие между молекулами жиров и воды обусловлено различием в их полярности. Молекулы жиров не имеют заметной полярности, так как они состоят главным образом из углеродных и водородных атомов, которые имеют одинаковую электроотрицательность. Это значит, что у этих молекул нет электрических полюсов, которые привлекали бы молекулы воды.
Поэтому, когда жиры попадают в воду, они не растворяются, а образуют так называемые "жирные пятна" или "жировые капли". Это происходит потому, что молекулы воды не могут образовать водородные связи с молекулами жиров и предпочитают образовывать связи друг с другом в кластерах.
Из-за своей нерастворимости в воде, жиры и масла часто выделяются на поверхность воды или собираются в каплях, которые можно затем удалить. Таким образом, взаимодействие молекул жиров и воды играет важную роль в многих физических и химических процессах, включая пищеварение, мытье посуды и очистку воды.
| Жиры | Вода |
|---|---|
| Гидрофобные | Полярный растворитель |
| Отсутствие полярности | Полярность |
| Не растворяются в воде | Образуют водородные связи |
| Формируют "жирные пятна" или капли | Образуют кластеры |
Различия в структуре жиров и воды
- Молекулы жиров состоят из глицерина и жирных кислот. Глицерин - это спиртовое соединение, имеющее гидрофобную (не любящую воду) группу. Жирные кислоты также имеют гидрофобные хвосты, состоящие из углеродных и водородных атомов. Такая структура делает жиры гидрофобными и плохо растворимыми в воде.
- Вода же представляет из себя молекулу, состоящую из одного атома кислорода и двух атомов водорода. Эта структура делает воду полярным растворителем, так как она содержит положительно заряженный конец (водород) и отрицательно заряженный конец (кислород). Благодаря своей полярности, вода образует водородные связи с другими поларными молекулами, что позволяет ей лучше растворяться, например с солью или сахаром.
Таким образом, различия в структуре молекул жиров и воды определяют их способность взаимодействовать друг с другом. Жирные молекулы, обладая гидрофобными хвостами, не образуют водородных связей с водой, что делает их плохо растворимыми в ней. Вода же, благодаря своей полярной структуре, может образовывать водородные связи с другими поларными молекулами, что обеспечивает ее способность хорошо растворять другие полярные вещества.
Роль гидрофобных хвостов жиров

Гидрофобные хвосты жиров играют ключевую роль в их нерастворимости в воде. Химическая структура жиров состоит из головных групп, которые смешиваются с водой, и гидрофобных хвостов, которые отталкивают воду.
Гидрофобные хвосты представляют собой длинные цепи углеродных атомов, связанных с водородными атомами. Из-за наличия этих хвостов, молекулы жиров имеют очень небольшую полярность, что делает их нерастворимыми в полярных растворителях, таких как вода.
Вместо того, чтобы смешиваться с водой, молекулы жиров образуют капли или слои, где гидрофобные хвосты встречаются друг с другом, минимизируя контакт с водой. Этот процесс называется агрегацией или микелляризацией.
Гидрофобные хвосты жиров также играют роль в структурировании клеточных мембран. Они образуют липидные бислои, которые составляют двойной слой вокруг клетки. Этот двойной слой защищает клетку и участвует в регуляции проницаемости мембраны.
Таким образом, гидрофобные хвосты жиров не только определяют их нерастворимость в воде, но и играют важную роль в организации клеточных структур и барьерных функциях мембран.
Эффекты нерастворимости жиров в воде

1. Формирование жирных капель
Жиры представляют собой агрегаты молекул, обладающие гидрофобными свойствами. Это означает, что они плохо взаимодействуют с водой, поскольку их молекулы обладают гидрофильными (водорастворимыми) и гидрофобными (нерастворимыми в воде) частями.
При взаимодействии с водой, молекулы жиров формируют капельки, которые остаются нерастворимыми и отдельными. Это связано с сильными гидрофобными силами, действующими между молекулами жиров, а также с отсутствием достаточного количества гидрофильных групп, способных взаимодействовать с водой.
2. Отделение жиров от воды
Одним из важных эффектов нерастворимости жиров в воде является их отделение от водных растворов. Это происходит в результате образования межфазной границы между жировыми каплями и водой. В результате этого эффекта, жиры выделяются в виде отдельных слоев или выпадают в осадок, отделяясь от водной фазы.
3. Влияние на молекулярные процессы
Нерастворимые жиры имеют важное влияние на различные молекулярные процессы, происходящие в живых организмах. Например, они играют важную роль в хранении энергии в виде жировых капель в клетках, а также в формировании защитных оболочек вокруг органов и нервных волокон.
Кроме того, нерастворимость жиров в воде оказывает влияние на активность ферментов, гормональные процессы и иммунную систему. Это связано с тем, что многие биохимические процессы протекают в водной среде, и жиры не могут непосредственно участвовать в них.



