Железо – один из самых распространенных и полезных металлов в мире. Оно используется во многих отраслях индустрии и строительства, благодаря своим уникальным свойствам. Однако есть одно любопытное свойство железа, которое отличает его от других металлов – оно горит в кислороде, но не горит на воздухе. В данной статье мы разберем, почему это происходит и каковы научные объяснения этому явлению.
Одной из основных причин того, что железо горит в кислороде, заключается в том, что оно реактивно в отношении кислорода. Это означает, что железо способно образовывать соединения с кислородом, что приводит к химической реакции, сопровождающейся выделением тепла и света. Такое горение железа в кислороде происходит при высоких температурах и может быть неустойчивым.
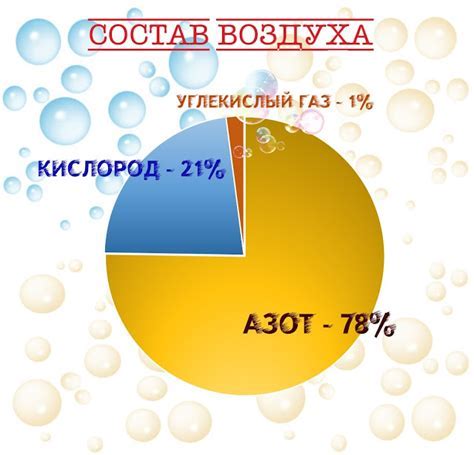
Однако этот процесс не может происходить на воздухе, так как воздух содержит около 78% азота, который инертен и не участвует в химических реакциях с железом. Кроме того, в атмосфере есть вода, которая распределяет и разбавляет кислород, не позволяя ему взаимодействовать с железом. Таким образом, железо не горит на воздухе, так как не образуется достаточное количество кислорода для начала реакции горения.
Причины горения железа в кислороде

Горение железа в кислороде происходит из-за нарушения соразмерности компонентов горящей смеси. Когда железо взаимодействует с кислородом, происходит окисление металла, при этом выделяется большое количество тепла. В результате, температура в зоне взаимодействия достигает очень высоких значений, благодаря чему она становится самосогревающейся.
Самосогревание зависит от ряда факторов, таких как размеры частиц железа, концентрация кислорода и эффективность смешения горящей смеси. Однако, горение железа в кислороде может происходить только внутри специальных устройств, которые обеспечивают безопасные условия для поддержания горения и предотвращения пожара.
- Окисление железа: внутри горящего материала происходит окисление железа, при этом образуются оксиды. Одним из наиболее распространенных оксидов железа является ржавчина (Fe2O3).
- Энергия выделения тепла: окисление железа в кислороде сопровождается выделением большого количества тепла. Благодаря этому, температура в зоне взаимодействия быстро повышается и может достигать значительных значений.
- Самосогревание: после начала горения железа в кислороде, процесс может продолжаться самостоятельно благодаря самосогреванию. При достижении определенного уровня температуры, воспламенение происходит без применения внешних источников огня.
Таким образом, горение железа в кислороде обусловлено окислительными свойствами кислорода, окислением железа с выделением тепла и наличием условий для самосогревания. Этот процесс может быть использован в некоторых технических устройствах, где необходимо обеспечить горение для выполнения определенных функций.
Образование окиси железа
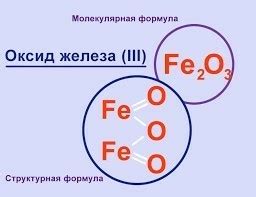
Окись железа (Fe2O3), или ржавчина, образуется при взаимодействии железа с кислородом воздуха. Процесс образования окиси железа известен как окисление железа.
Когда железо находится в контакте с кислородом, происходит окислительно-восстановительная реакция. Железо "отдает" электроны кислороду, при этом само становится окислителем, а кислород - восстановителем.
Реакция между железом и кислородом протекает не мгновенно, а со временем. В результате образуется слой окиси железа на поверхности железа. Этот слой является защитой для железа от дальнейшего окисления.
Однако, если поверхность железа повреждается или становится доступна кислороду, окисление железа продолжается и образуется новый слой окиси. В результате продолжительного окисления железо может использоваться практически полностью.
Следует отметить, что важной ролью в процессе образования окиси железа воздуха играет влажность. Влага присутствующая в воздухе повышает скорость окисления железа и образования окиси. Также влага способствует образованию ржавчины во внутренних пустотах и трещинах железных предметов.
Образование окиси железа является неизбежным процессом для железа, находящегося на открытом воздухе. Поэтому для предотвращения окисления и сохранения железных предметов в хорошем состоянии, требуется их защита от воздействия кислорода и влаги. Для этого используют различные методы, такие как покрытие предмета защитным слоем или хранение в герметичных контейнерах.
Взаимодействие железа и кислорода
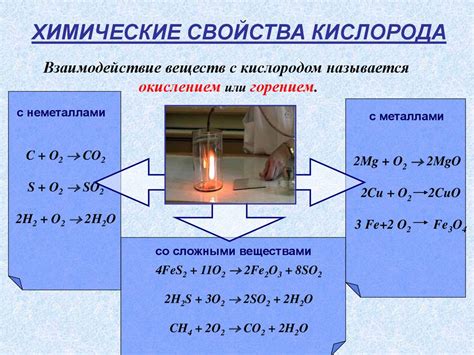
Железо, будучи активным металлом, может взаимодействовать с кислородом и образовывать оксиды. В чистом кислороде или в присутствии кислород-содержащих соединений, таких как вода или воздух, железо окисляется.
Этот процесс, называемый окислением, приводит к образованию железного оксида, наиболее распространенного из которых является ржавчина (Fe2O3). Ржавчина имеет красно-коричневый оттенок и образуется на поверхности железа в результате окисления.
Кислород с активными металлами взаимодействует намного быстрее, чем с неактивными металлами. В присутствии влаги или влажного воздуха, окисление железа происходит гораздо быстрее.
| Вещество | Реакция |
|---|---|
| Железо (Fe) | Fe + 3/2 O2 → Fe2O3 |
Однако, если кислород отсутствует или находится в недостаточном количестве, окисление железа не происходит и оно не горит. Воздух, в отличие от чистого кислорода, содержит оксиды азота и углекислый газ, которые могут замедлять или препятствовать окислительной реакции.
Таким образом, горение железа возможно только в присутствии достаточного количества кислорода и отсутствии химических веществ, которые могут замедлять реакцию.
Реакция ржавления

Ржавление - это процесс окисления железа в присутствии влаги и кислорода. Когда железо контактирует с водой и кислородом, происходит реакция, в результате которой образуется оксид железа (III), более известный как ржавчина.
Основные этапы реакции ржавления выглядят следующим образом:
| Этапы реакции | Описание |
|---|---|
| 1 | Образование ржавчины на поверхности железа |
| 2 | Диффузия воды и кислорода через слой ржавчины |
| 3 | Проникновение реакционных продуктов в железо |
| 4 | Распространение реакции внутри железа |
Эта реакция является внутренним процессом, поэтому железо не горит на воздухе, где содержание кислорода существенно меньше, чем в кислороде. Горение железа в кислороде и реакция ржавления - разные протекающие одновременно процессы.
Почему железо не горит на воздухе
Ответ на этот вопрос можно найти в защитной пленке, называемой оксидной пленкой, которая образуется на поверхности железа при взаимодействии с кислородом. Оксидная пленка представляет собой слой оксида железа, который защищает металл от дальнейшей реакции с кислородом и предотвращает его горение.
| Процесс образования оксидной пленки | Реакция |
|---|---|
| Окисление железа (Fe) | 4Fe + 3O2 → 2Fe2O3 |
| Образование оксидной пленки (Fe2O3) | Fe2O3 + xH2O → xFe2O3·xH2O |
Оксидная пленка имеет плотную структуру и покрывает всю поверхность железа, создавая непроницаемый барьер для дальнейшего окисления. Это объясняет, почему железо не горит на воздухе, несмотря на наличие кислорода.
Однако, если оксидная пленка нарушается или полностью удаляется с поверхности железа, то металл может начать гореть. Например, при нагревании железа до высоких температур или его обработке сильными окислителями. При этом окисление протекает необратимо и сопровождается ярким свечением и выделением тепла.
Таким образом, железо не горит на воздухе благодаря защитной оксидной пленке, которая предотвращает его дальнейшее окисление в присутствии кислорода.
Реакция с кислородом воздуха

Реакция между железом и кислородом начинается с образования оксида железа(II) (FeO), участвующего далее в окислительно-восстановительных реакциях и окисляется до оксида железа(III) (Fe2O3). Также взаимодействие с кислородом приводит к образованию оксида углерода (CO), особенно при недостатке кислорода.
Однако, по сравнению с горением на кислороде, реакция с кислородом воздуха происходит намного медленнее и без выделения яркого пламени. Это происходит из-за наличия воздуха, в котором содержится азот. Азот, будучи инертным газом, препятствует быстрому распространению кислорода и снижает скорость реакции.
Образование стабильной пленки на поверхности металла

Когда чистое железо вступает в контакт с кислородом, происходит процесс окисления, при котором образуется оксид железа. В таких условиях поверхность металла активно взаимодействует с кислородом, что способствует образованию пленки из оксида железа.
Стабильная оксидная пленка на поверхности металла защищает его от дальнейшего окисления. Эта пленка является барьером для кислорода и предотвращает его проникновение внутрь металла. Когда пленка достаточно толстая и непроницаемая, окисление железа прекращается и, следовательно, горение тоже.
Однако, при взаимодействии железа с воздухом, на его поверхности образуется тонкая пленка оксида железа, но она не является столь стабильной, как в случае с взаимодействием с кислородом. Поэтому этой пленкой невозможно полностью предотвратить окисление железа, и горение не происходит.
Защитное поведение железа

Железо обладает уникальными свойствами, которые обуславливают его поведение в кислороде и на воздухе.
Когда железо находится в кислородной среде, происходит окисление металла, при котором на поверхности железа образуется оксидное покрытие. Это покрытие предупреждает продолжение окисления других частей металла и действует, как защита для дальнейшего разрушения железа.
Однако, когда железо находится на воздухе, окисление происходит медленнее. При этом на поверхности металла образуется тонкий слой оксида, который быстро загрязняется и превращается в ржавчину. Ржавчина не является защитной и может привести к дальнейшему разрушению железа.
Важно также отметить, что кислород значительно активнее в растворенной форме, поэтому окисление железа быстрее происходит в кислых средах, таких как кислотные дожди или растворы соляной кислоты. Вещества, такие как вода и влажный воздух, также могут ускорять окисление железа.
Интересно, что добавление специальных примесей, таких как никель или хром, влияет на окисление железа. Эти элементы создают защитные покрытия на поверхности металла и предотвращают его дальнейшее разрушение.
В результате, защитное поведение железа в кислороде и на воздухе объясняется формированием оксидного покрытия на поверхности и влиянием внешних факторов, таких как влага и примеси.
| Окружающая среда | Поведение железа |
| Кислородная среда | Образование защитного оксидного покрытия |
| Воздух | Образование ржавчины |
| Кислые среды | Ускоренное окисление железа |
Механизмы горения железа в кислороде

Во-первых, для горения необходимо наличие трех ключевых компонентов: топлива, окислителя и источника активации. В случае с железом, самим топливом является металлическое железо, а окислителем – кислород. Для активации горения требуется начальное нагревание.
В кислороде железо горит благодаря реакции между железом и кислородом, при которой происходит окисление железа. Начальное нагревание, как правило, осуществляется при помощи внешнего источника тепла, такого как пламя газового факела или электрическая дуга. При достижении определенной температуры активируется окислительное взаимодействие между железом и кислородом, и начинается горение железа.
Реакция горения железа в кислороде может быть представлена уравнением:
4Fe + 3O2 → 2Fe2O3
В результате этой реакции образуется окись железа (Fe2O3), которая имеет красно-коричневый цвет и обычно называется ржавчиной.
По сравнению с кислородом, воздух содержит около 78% азота. Этот азот не является окислителем, и, соответственно, не способствует проведению реакции горения железа. Кроме того, наличие азота может замедлить процесс горения, так как азот может действовать как инертный газ, поглощая часть тепла и замедляя химическую реакцию.
Таким образом, железо горит в кислороде благодаря окислительному взаимодействию между железом и кислородом, при наличии начального нагревания. На воздухе, из-за присутствия азота, железо не может успешно гореть из-за отсутствия достаточно активного окислителя.
Каталитическое горение

Каталитическое горение возможно благодаря взаимодействию горючего материала с каталитическим веществом, которое ускоряет химическую реакцию горения. В отличие от обычного горения, каталитическое горение происходит без значительного повышения температуры.
Обратимся к примеру горения железа. Обычно железо горит в кислороде, но не горит на воздухе. При этом наличие каталитического материала, такого как катализатор или вещество с каталитическим действием, может сделать возможным горение железа при низкой температуре.
В каталитическом горении, каталитическое вещество вступает в реакцию с горючим материалом и ускоряет процесс окисления. Каталитические вещества могут принимать участие в реакции, не потребляясь полностью, и многократно участвовать в других реакциях.
Каталитическое горение имеет множество применений в промышленности. Например, катализаторы используются в автомобилях для очистки отработавших газов от вредных веществ. Каталитическое горение также может быть использовано для повышения эффективности горения при производстве энергии или для контроля процессов сгорания в различных химических процессах.
Понижение температуры воспламенения

Когда железо находится на воздухе, оно окисляется за счет взаимодействия с кислородом, но при этом не воспламеняется. Это происходит потому, что для полного горения железа необходимо достичь определенной температуры, которая ниже, чем при окислении.
Однако, если железо находится в кислородной среде, происходит активное взаимодействие между железом и кислородом. При этом, железо нагревается до более высокой температуры, которая превышает температуру воспламенения. В результате происходит окисление железа с выделением тепла и света – железо начинает гореть.



