Существует бесчисленное количество элементов в периодической системе химических элементов, и каждый из них имеет свои уникальные свойства и характеристики. Два из таких элементов - хром и сера - могут показаться подобными на первый взгляд, но, несмотря на их схожесть, они принадлежат к разным подгруппам.
Хром и сера - это элементы, которые находятся в разных группах периодической системы. Хром относится к группе переходных металлов, в то время как сера относится к группе неметаллов. Главная причина, по которой они принадлежат к разным подгруппам, заключается в их электронной конфигурации и свойствах.
Хром, с символом Cr и атомным номером 24, имеет электронную конфигурацию [Ar] 3d5 4s1. Он обладает высокой термической и электрической проводимостью, а также является очень твердым металлом. Хром также обладает особой способностью придавать яркий цвет многим материалам, благодаря своим особым свойствам дифракции и интерференции света.
Сера, с символом S и атомным номером 16, имеет электронную конфигурацию [Ne] 3s2 3p4. Она является химическим элементом, который встречается в различных формах, включая кристаллический серу, каменноугольную серу и многое другое. Сера является неметаллом и обладает термической и электрической изоляцией. Она также является важным элементом для многих биологических процессов и соединений.
Таким образом, несмотря на некоторую схожесть между хромом и серой, их различие определяется их электронной конфигурацией, химическими и физическими свойствами, а также их принадлежностью к разным подгруппам элементов в периодической системе химических элементов.
Принадлежность хрома и серы к разным подгруппам элементов: причины различий

Принадлежность хрома и серы к разным подгруппам элементов в таблице химических элементов объясняется их электронной структурой и свойствами.
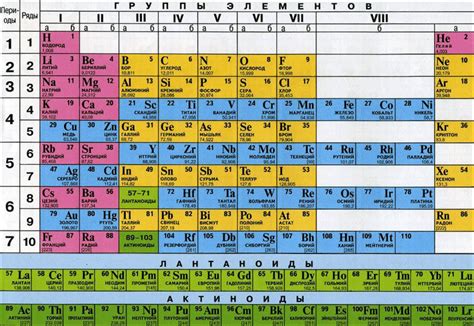
Хром (Cr) принадлежит к 6-й группе элементов периодической таблицы, также известной как группа VIb или группа "хрома". Этот элемент имеет атомный номер 24 и его электронная конфигурация [Ar] 3d5 4s1. Он является переходным металлом и обладает такими свойствами, как высокая твёрдость, коррозионная стойкость и способность образовывать разнообразные соединения с различными степенями окисления. Хром широко используется в металлургии, химической промышленности и других отраслях.
Сера (S), с другой стороны, принадлежит к 6-й группе побочных подгрупп (второй период) элементов периодической таблицы. Её атомный номер - 16, а электронная конфигурация - 1s2 2s2 2p6 3s2 3p4. Сера - полунеметалл с характерным жёлтым цветом и хорошо известной свойством образовывать резкий запах при окислении. Она широко используется в химии, геологии и других областях, в том числе в производстве удобрений, пластиков, лекарств и косметических препаратов.
Таким образом, различия в принадлежности хрома и серы к разным группам и подгруппам элементов связаны с их разной электронной структурой, свойствами и применением в различных отраслях.
Химические свойства и расположение хрома в периодической таблице

Хром обладает рядом уникальных химических свойств, которые определяют его широкое применение в различных отраслях. Например, хром обладает высокой коррозионной стойкостью и устойчивостью к окислительным воздействиям, благодаря чему широко используется в производстве стали и других сплавов. Он также образует стабильные соединения с другими элементами, что делает его незаменимым в химической промышленности.
Хром имеет несколько степеней окисления, включая +2, +3 и +6. Окисление хрома в различные степени позволяет образование различных соединений с разными свойствами. Например, соединение хрома в степени окисления +6 - хромовая кислота - обладает сильной окислительной активностью и используется в процессах озонирования воды. Соединение хрома с окислением +3 - хромовые соли - имеет широкое применение в производстве красителей и пигментов.
Хром находится в периодической таблице между элементами ванадий (V) и марганец (Mn). Он принадлежит к периоду 4 и блоку d. Расположение хрома в периодической таблице указывает на его электронную конфигурацию и химические свойства. В периодической системе элементов хром занимает место среди переходных металлов, которые обладают разнообразными свойствами и образуют широкий спектр соединений.
Строение и свойства серы, и ее место в периодической таблице
Строение серы довольно интересно. В жидком состоянии она представлена в виде S[strong]8[/strong] молекул, которые образуют короткие цепи. Однако при переходе в твердое состояние сера образует моноклиническую решетку, состоящую из S[strong]8[/strong] кольцевых молекул, соединенных между собой.
Сера обладает несколькими важными физическими и химическими свойствами. Она имеет характерный желтый цвет и может встречаться в различных аллотропных формах, таких как ромбическая и моноклиническая сера. Одним из наиболее удивительных свойств серы является ее способность переходить из твердого состояния в жидкое при комнатной температуре. Это позволяет сероводороду образовываться при взаимодействии серы с кислородом. Также сера обладает высокой термической и электрической проводимостью.
Как упоминалось ранее, сера принадлежит к группе кальциогенов, в которую также входят элементы кислород (O), селен (Se), теллур (Te) и полоний (Po). Она занимает шестое место в периодической таблице, после кислорода. Несмотря на различные свойства и химическую активность серы, ее место в таблице позволяет нам установить связи между ее химическими свойствами и свойствами других элементов из той же группы.



