Хлор, бром и йод принадлежат к халкогенам - группе элементов периодической таблицы, которые образуют ионы с отрицательным зарядом, называемые галогенидами. Хлор, бром и йод могут образовывать соли со многими элементами, но хлор обладает более сильными химическими свойствами в своих солях по сравнению с бромом и йодом. Это можно объяснить несколькими факторами.
1. Размер атома
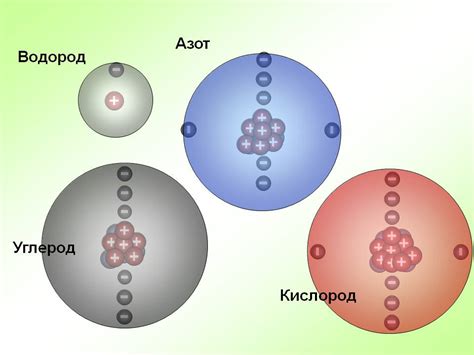
Хлор имеет наименьший атомный радиус среди галогенов. Это означает, что хлоровый атом обладает более сильным притяжением к электронам, чем бромовый и йодовый атомы. Благодаря этому, ионы хлора в солях имеют более высокую зарядовую плотность, что делает их более стабильными и менее склонными к реакции.
2. Электроотрицательность

Хлор обладает наибольшей электроотрицательностью среди галогенов. Этот параметр характеризует способность атома притягивать электроны к себе. Большая электроотрицательность хлора обусловлена его малым размером и сильным притяжением к электронам. В солях, ионы хлора притягивают электроны к себе сильнее, образуя более стабильные ионы, что придает большую прочность связи и делает хлор более сильным элементом в комплексных соединениях.
3. Поляризуемость

Хлор обладает наименьшей поляризуемостью среди галогенов. Поляризуемость - это способность атома иона деформировать его электронный облако под воздействием электрического поля. Благодаря своей малой поляризуемости, ионы хлора легче окружаются водородными атомами и образуют более компактные и устойчивые структуры, что делает соли с хлором более прочными и стабильными.
В результате, хлор обладает большей химической активностью и силой в своих солях по сравнению с бромом и йодом. Однако, все три элемента имеют свои характеристики и применение в различных областях науки и промышленности.
Свойства и реактивность хлора
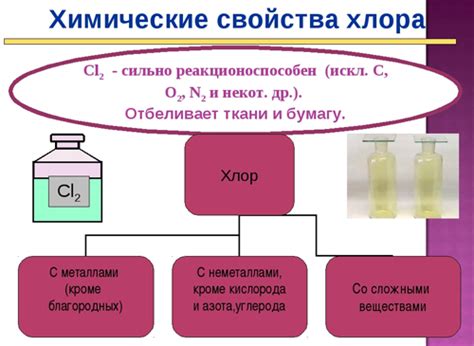
Физические свойства хлора включают его желто-зеленый цвет при комнатной температуре и газообразное состояние. Он обладает характерным запахом и является токсичным веществом.
Химическая реактивность хлора объясняется его электроотрицательностью и высокой электронной аффинностью. Хлор способен реагировать с большим количеством элементов и соединений.
Хлор образует соли с металлами, такими как натрий и калий. Например, в соединении натрийхлорида (NaCl), хлор замещает один атом натрия, что приводит к образованию ионов Na+ и Cl-. Соли хлора широко используются в пищевой промышленности, а также в процессе очистки воды.
Хлор реагирует с водородом, образуя соляную кислоту (HCl). Эта реакция происходит с выделением тепла и сопровождается выделением хлороводородного газа. Соляная кислота является одним из основных промышленных химических соединений и широко используется в различных отраслях.
Хлор может быть использован в реакциях окисления-восстановления. Например, он способен окислять металлы, образуя кислоты и соли. Также хлор реагирует с неорганическими и органическими веществами, проявляя окислительные свойства.
Хлор является сильным белением и дезинфицирующим средством. Он широко применяется в хлорировании воды, процессе обработки бассейнов и в производстве хлорорганических соединений. Белый порошок, известный как хлорное известковое молоко, содержащий хлор, используется для отбеливания и стерилизации.
Сильные свойства и реактивность хлора делают его важным компонентом в различных промышленных и химических процессах.



