Внутренняя энергия системы – это сумма кинетической и потенциальной энергии всех ее молекул. Она характеризует внутреннее состояние системы и зависит от ее температуры, давления и других параметров. Внутренняя энергия никогда не может быть равной нулю по ряду физических и термодинамических причин.
Во-первых, по теореме о полной энергии, внутренняя энергия системы включает в себя не только кинетическую и потенциальную энергию молекул, но и энергию связи между ними. Даже при абсолютном нуле температуры (которое само по себе крайне трудно достичь), молекулы всегда будут обладать ненулевой энергией связи, что делает внутреннюю энергию невозможной для достижения значения ноль.
Во-вторых, согласно третьему закону термодинамики, при абсолютном нуле температуры возникает феномен, называемый абсолютной неподвижностью. Это означает, что все движения молекул останавливаются, но их энергия не исчезает. Молекулы все еще обладают нулевой точной скоростью, но сохранившиеся энергии связей содействуют существованию внутренней энергии системы.
Таким образом, независимо от условий, невозможно достичь нулевой внутренней энергии системы. Внутренняя энергия всегда будет присутствовать как фундаментальная характеристика состояния материальной системы и выбросить ее на пустое место – физически невозможно.
Термодинамическое определение внутренней энергии
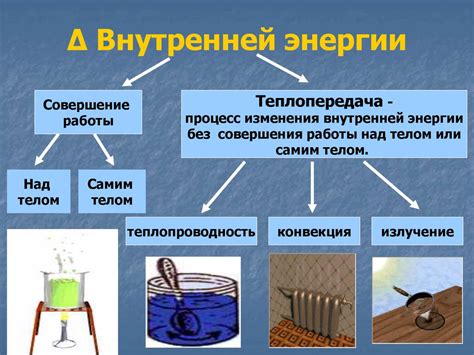
Согласно термодинамике, внутренняя энергия системы – это энергия, которую система содержит за счет своих внутренних макроскопических степеней свободы. Макроскопические степени свободы могут включать энергию колебаний атомов вещества, энергию вращения молекул и энергию переходов между энергетическими уровнями.
Для того чтобы лучше понять значение внутренней энергии, рассмотрим простой пример. Представим замкнутую систему, например, газ в закрытом контейнере. Внутренняя энергия этой системы будет состоять из суммы кинетической и потенциальной энергии всех его молекул. При этом, внутренняя энергия может изменяться в зависимости от изменения температуры, объема или состава газа.
Важно понимать, что внутренняя энергия не может быть равна нулю, так как даже в теле, при абсолютном нуле температуры, молекулы все еще находятся в движении и обладают энергией, связанной с их квантовыми состояниями.
Термодинамическое определение внутренней энергии позволяет нам лучше понять свойства веществ и использовать ее для описания различных физических и химических процессов.
| Главное | Таблица |
|---|---|
| Термодинамическое определение внутренней энергии | Суммарная энергия всех частиц вещества |
| Пример внутренней энергии | Кинетическая и потенциальная энергия молекул газа |
| Внутренняя энергия и абсолютный нуль | Молекулы все еще обладают энергией |
Законы сохранения энергии

Законы сохранения энергии представляют собой фундаментальные принципы, которые описывают взаимосвязь между различными формами энергии в системе.
Первым законом сохранения энергии, также известным как принцип сохранения энергии, является закон сохранения энергии в замкнутой системе. В соответствии с этим законом, полная энергия в системе остается постоянной, если внешние силы не совершают работу или не производят тепло.
Вторым законом сохранения энергии является закон сохранения механической энергии. Он гласит, что сумма кинетической и потенциальной энергии замкнутой системы остается постоянной, если на нее не действуют внешние силы, совершающие работу или производящие тепло.
Третий закон сохранения энергии называется закон сохранения энергии в неупругих столкновениях. Согласно этому закону, общая энергия замкнутой системы остается постоянной, даже если происходит преобразование механической энергии в другие формы энергии, такие как тепло или звук.
Законы сохранения энергии имеют большое значение в физике, так как позволяют предсказывать и объяснять поведение системы в различных условиях. С их помощью можно изучать и оптимизировать энергетические процессы, а также анализировать взаимодействие различных объектов и систем.
Взаимные превращения энергии

Внутренняя энергия системы представляет собой сумму энергий всех ее микроскопических частиц, включая их потенциальную и кинетическую энергию. В то время как внутренняя энергия не может быть равна нулю, она может изменяться в результате взаимных превращений энергии.
Взаимные превращения энергии могут происходить различными способами, включая механическую, тепловую, электрическую и химическую работу. Например, в случае механической работы, приложенная сила может изменять положение частиц в системе и тем самым изменять их потенциальную энергию. Тепловая работа происходит, когда энергия передается между системой и окружающей средой в виде тепла.
Взаимные превращения энергии могут быть описаны законами сохранения энергии, в том числе законами сохранения механической и тепловой энергии. Например, закон сохранения механической энергии утверждает, что сумма кинетической и потенциальной энергий системы остается постоянной, если на нее не действуют внешние силы.
Таким образом, внутренняя энергия системы может изменяться в результате взаимных превращений энергии, но она не может быть равна нулю в силу законов сохранения энергии.
Влияние температуры на внутреннюю энергию

При повышении температуры молекулы начинают двигаться более интенсивно, что приводит к увеличению потенциальной энергии между ними. В результате, внутренняя энергия вещества становится больше. Если температура достигает абсолютного нуля (–273,15 °C), то все молекулы перестают двигаться и внутренняя энергия вещества равна нулю.
Таким образом, внутренняя энергия не может быть равна нулю при любой положительной температуре. Вплоть до абсолютного нуля, увеличение температуры приводит к увеличению внутренней энергии. Это объясняется тем, что при повышении температуры молекулы вещества начинают двигаться с большей энергией и совершают больше потенциальной энергии при взаимодействии.
Энтропия и внутренняя энергия
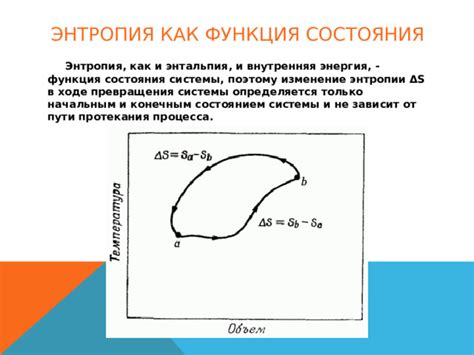
Внутренняя энергия, с другой стороны, является суммой всех форм энергии внутри системы, включая кинетическую и потенциальную энергию частиц, энергию связи, тепловую энергию и другие формы энергии, с которыми система может обмениваться.
Второе начало термодинамики утверждает, что энтропия изолированной системы всегда стремится увеличиваться. Следовательно, при условии сохранения энергии, внутренняя энергия системы также не может быть равной нулю.
Когда энтропия в системе стремится к минимуму, это означает, что система пришла к состоянию равновесия, а внутренняя энергия системы не может изменяться без внешнего воздействия или перехода энергии через ее границы.
Понимание взаимосвязи между энтропией и внутренней энергией системы важно при изучении термодинамики и процессов, происходящих в физических и химических системах. Энтропия и внутренняя энергия являются ключевыми понятиями, которые позволяют описать и объяснить поведение системы в состоянии равновесия или изменяющегося состояния.
Процессы, при которых внутренняя энергия может изменяться
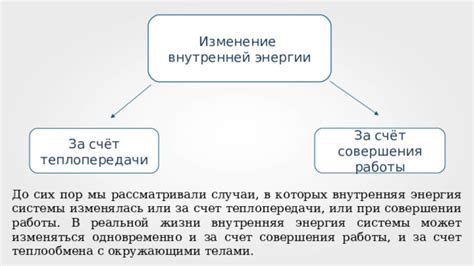
Теплообмен представляет собой передачу энергии между системой и окружающей средой в результате разницы температур. Когда система получает тепло, ее внутренняя энергия увеличивается. Например, если нагреть воду на плите, тепло от плиты передается воде, что приводит к увеличению ее внутренней энергии.
Работа - это энергия, передаваемая системой или получаемая от нее в результате механического воздействия. Работа может изменять внутреннюю энергию системы. Например, при сжатии пружины внутренняя энергия системы увеличивается, так как работа в результате сжатия пружины превращается в потенциальную энергию ее молекул.
Таким образом, внутренняя энергия может изменяться в процессе теплообмена и работы. При получении тепла или совершении работы система поглощает энергию и ее внутренняя энергия увеличивается. При отдаче тепла или совершении работы система отдает энергию и ее внутренняя энергия уменьшается.
| Процесс | Изменение внутренней энергии системы |
|---|---|
| Получение тепла | Увеличение |
| Отдача тепла | Уменьшение |
| Совершение работы | Увеличение |
| Поглощение работы | Уменьшение |
Показатели внутренней энергии в различных системах

В газовых системах показатели внутренней энергии связаны с энергией движения молекул и их взаимодействиями. Внутренняя энергия идеального газа зависит только от температуры системы и определяется формулой:
U = Cv * T
где U – внутренняя энергия, Cv – молярная удельная теплоемкость при постоянном объеме, T – температура системы.
В твердых телах внутренняя энергия связана с энергией движения и колебания атомов или ионов в решетке твердого тела. Внутренняя энергия твердого тела выражается через удельную теплоемкость при постоянном давлении и изменение температуры:
U = Cp * T
где U – внутренняя энергия, Cp – молярная удельная теплоемкость при постоянном давлении, T – температура системы.
В жидких системах внутренняя энергия связана с энергией движения молекул и их взаимодействием. Внутренняя энергия жидкости определяется путем учета изменения теплоты и работы системы:
U = Q - W
где U – внутренняя энергия, Q – теплота, W – работа.
Невозможность наличия внутренней энергии равной нулю обусловлена существованием межатомных и межмолекулярных сил в системе. Даже в крайне низкотемпературных условиях, вещество не находится в полной покоя и частицы все равно обладают некоторой энергией.
Внутренняя энергия является важной характеристикой системы и играет роль во многих физических явлениях. Понимание и изучение внутренней энергии позволяет предсказывать и объяснять поведение вещества при различных условиях, включая изменения температуры, давления и объема системы.
Таким образом, внутренняя энергия всегда присутствует в системе и не может быть равной нулю из-за наличия межатомных и межмолекулярных взаимодействий.



