Видимый нам мир поражает своим разнообразием форм и текстур, но что происходит, когда объективная реальность сталкивается с нашими представлениями о ней? Почему, упав на пол, ваза не рассыпается на мелкие кусочки, как мы ожидаем?
Ответ кроется в структуре молекул, из которых состоит материал, из которого изготовлен предмет. Молекулы предметов своего рода "держатся вместе" благодаря силам, называемым химическими связями. Эти связи имеют определенную прочность и способны противостоять внешним воздействиям.
В случае вазы, ее материал, вероятнее всего, состоит из стекла - очень твердого и хрупкого материала. Химические связи между молекулами стекла обеспечивают его прочность и стабильность.
В то время как внешнее воздействие, такое как падение на пол, может создать силу нарушения связей между молекулами, структура всего материала остается целой и предотвращает разрушение вазы на мелкие кусочки.
Исследование структуры молекул и сил, обусловленных химическими связями, помогает нам понять, почему предметы ведут себя таким образом и как мы можем предотвратить разрушение материала.
Структура молекул и прочность ваз
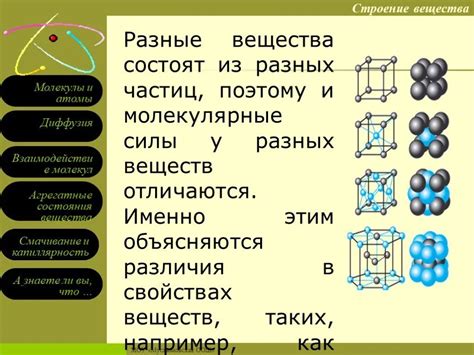
Вазы, как и многие другие предметы, изготавливаются из различных материалов, таких как стекло, керамика или металл. Когда ваза падает на пол, она обычно не рассыпается на мелкие кусочки, а может разбиться на несколько крупных обломков или даже остаться целой.
Чтобы понять, почему это происходит, нужно взглянуть на структуру молекул материала, из которого изготовлена ваза. В основе большинства материалов лежат атомы, которые связываются друг с другом, формируя молекулы. Силы связи между этими атомами могут быть различными и определять прочность материала.
Стекло, например, состоит из молекул кремния и кислорода, связанных великим количеством ковалентных связей. Эти связи очень прочные и позволяют стеклу быть хрупким материалом. Когда ваза падает, ковалентные связи в молекулах стекла могут разрушиться, и из-за этого стекло разбивается на крупные обломки.
Керамические вазы могут быть изготовлены из разных видов керамики, но основу составляют молекулы, связанные ионными или ковалентными связями. Керамика может быть более прочным материалом, чем стекло, и поэтому она может выдерживать большее количество силы, прежде чем разбиться. Однако, керамические вазы все равно могут разрушаться на крупные обломки.
Металлические вазы изготавливаются из металлов, состоящих из атомов, связанных металлическими связями. Металлические связи обладают высокой прочностью и эластичностью, что позволяет металлическим вазам сохранять свою форму при небольших воздействиях. При сильном ударе, металлическая ваза может деформироваться, но не разрушиться и останется целой.
Таким образом, структура молекул влияет на прочность и хрупкость материала. Изучение связей и структуры молекул помогает понять, почему вазы не рассыпаются на мелкие кусочки при падении, а разбиваются на крупные обломки или остаются целыми.
Молекулярная сила и ее влияние на прочность

Молекулы вещества связываются друг с другом через химические связи, создавая структуру материала. Молекулярная сила определяется силой этих связей. В случае прочного материала, молекулярная сила будет высокой, и связь между молекулами будет плотной и прочной.
Если молекулярная сила низкая, связи между молекулами будут слабыми, что приводит к низкой прочности материала. В таком случае, при воздействии внешних сил материал будет легко разрушаться и распадаться на мелкие кусочки.
Молекулярная сила также может изменяться в зависимости от условий эксплуатации материала. Воздействие тепла, влаги или других факторов может ослабить молекулярные связи, что может привести к ухудшению прочности материала.
Изучение молекулярной силы и ее влияния на прочность материала позволяет улучшить качество материалов и разрабатывать более прочные и долговечные изделия. Это важно в таких отраслях, как строительство, авиация, автомобилестроение и многих других.
Межмолекулярные взаимодействия
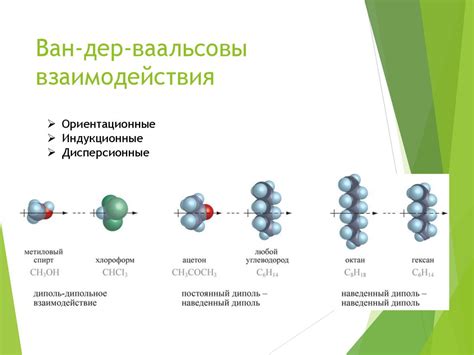
Молекулы вещества могут взаимодействовать друг с другом, образуя межмолекулярные связи. Эти взаимодействия играют важную роль в структуре и свойствах материалов.
Одним из типов межмолекулярных взаимодействий является ван-дер-ваальсово взаимодействие, которое возникает между атомами и молекулами вследствие дипольных и моментных флуктуаций и временных зарядов. Это слабое взаимодействие, которое не создает постоянных связей между молекулами, но обеспечивает их сближение.
Другим типом межмолекулярных взаимодействий является водородная связь. Водородный атом, связанный с электроотрицательным атомом, может образовать водородную связь с другим электроотрицательным атомом, обладающим несвязанными электронными парами. Водородные связи являются сильными и могут играть важную роль в структуре молекулы.
Электростатические взаимодействия также являются важными межмолекулярными взаимодействиями. Заряженные частицы притягиваются друг к другу в результате электрических сил. Такие взаимодействия могут быть как притягивающими, так и отталкивающими в зависимости от знака заряда.
Межмолекулярные взаимодействия определяют многочисленные свойства вещества, включая его плотность, кипение, вязкость, растворимость и т. д. Изучение этих взаимодействий помогает нам лучше понять структуру и свойства материалов, а также разрабатывать новые вещества с улучшенными характеристиками.
Кристаллическая структура и устойчивость
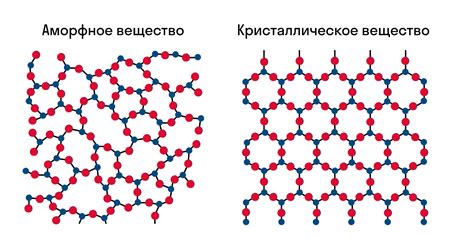
Кристаллическая структура веществ играет важную роль в их устойчивости. В отличие от аморфных материалов, в которых молекулы располагаются в произвольном порядке, кристаллические вещества имеют регулярную и повторяющуюся структуру.
Молекулы в кристаллах укладываются в определенном порядке, образуя решетку. Эта решетка создает прочное соединение между молекулами, что делает кристаллы устойчивыми и прочными.
Кристаллическая структура позволяет веществам иметь определенные свойства, такие как твердость, точка плавления и оптические свойства. Например, кристаллы симметричной структуры, такие как алмаз, обладают высокой твердостью и прочностью.
Устойчивость кристаллов обусловлена тем, что изменение структуры может нарушить регулярное расположение молекул и нарушить силы взаимодействия между ними. Это может привести к разрушению кристалла и теряе его свойств.
Изучение кристаллической структуры веществ позволяет нам понять, почему некоторые материалы более устойчивы и прочны, а другие могут быть легко разрушены или изменить свои свойства под действием внешних факторов.
Роль связей в прочности вещества

Связи между молекулами вещества играют важную роль в его прочности. Эти связи определяют, насколько тесно молекулы удерживаются вместе и как легко они могут двигаться или разделяться при воздействии напряжения.
Ковалентные связи – это сильные связи между атомами, в которых электроны общие между двумя атомами. Эти связи играют особенно важную роль в прочности кристаллических веществ, таких как алмазы и кварц. Ковалентные связи держат атомы вместе, создавая прочную структуру.
Ионные связи, которые происходят при образовании ионов. Они создаются силами притяжения между положительно и отрицательно заряженными ионами. Ионные связи также могут быть очень прочными и сильными.
В неорганических веществах, таких как стекло и керамика, прочность может быть обеспечена комбинацией ковалентных и ионных связей.
Металлические связи происходят между атомами в металлической решетке. Они создаются путем обмена свободно движущимися электронами между атомами металла. Металлические связи обладают высокой прочностью и эластичностью, что делает металлы одними из самых прочных материалов.
Осознание роли связей в прочности вещества помогает нам понять, почему некоторые материалы ломаются легко, а другие остаются прочными даже при больших нагрузках.
Атомы, ионы и связи между ними
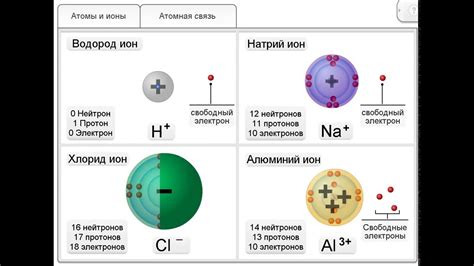
Атомы - это мельчайшие частицы, из которых состоят все вещества в мире. Каждый атом состоит из ядра и электронной оболочки. В ядре находятся протоны и нейтроны, а вокруг ядра движутся электроны по некоторым энергетическим орбитам.
Атомы могут образовывать соединения путем обмена электронами с другими атомами. Эти электроны называются валентными электронами и они находятся на самой внешней оболочке атома.
Связи между атомами образуются благодаря взаимодействию их валентных электронов. Атомы могут образовывать различные типы связей: ионные, ковалентные, металлические.
Ионные связи формируются между атомами, обладающими разными значениями электроотрицательности. При образовании ионной связи один атом отдает один или несколько электронов другому атому. В результате образуется положительно и отрицательно заряженный ионы, которые притягиваются друг к другу.
Ковалентные связи образуются между неметаллическими атомами. В молекуле каждый атом делит свои валентные электроны с другими атомами, образуя пары электронов, которые перемещаются между атомами.
Металлические связи характерны для металлов. В металлах электроны не связаны с отдельными атомами, а свободно движутся по всей структуре металла. Такие связи называются металлическими, они обеспечивают металлы их уникальными свойствами, такими как хорошая проводимость электричества и тепла.
Изучение структуры молекул и связей между атомами позволяет не только понять, почему ваза не рассыпается на мелкие кусочки, но и объяснить множество других явлений в наномире и микромире.
Наноструктуры в материалах

Основные особенности наноструктур в материалах:
- Увеличенная поверхность. Наноструктуры имеют большую поверхность по сравнению с объемом, что позволяет им обладать высокой реактивностью и активностью в химических реакциях.
- Квантовые эффекты. В наноматериалах наблюдаются особые квантовые эффекты, например, квантовое размерное ограничение, квантовая туннелирование и квантовая точка.
- Улучшенные механические свойства. Наноструктуры имеют уникальные механические свойства, такие как высокая прочность, гибкость и жесткость. Это обусловлено особенностями структуры на нанометровом уровне.
- Оптимальные оптические свойства. Многие наноматериалы обладают оптимальными оптическими свойствами, такими как поглощение и рассеивание света, эффекты плазмона и оптическое усиление.
- Новые электронные свойства. Наноструктуры позволяют создавать материалы с новыми электронными свойствами, такими как квантовые точки, одномерные наноразмерные структуры и наноэлектроника.
Благодаря своим уникальным свойствам, наноструктуры нашли применение во многих сферах, включая электронику, оптику, медицину, энергетику и технологии будущего.
Микроструктура и свойства

Структурные особенности молекул вещества влияют на его свойства. В основе структуры материала лежит расположение и взаимодействие атомов и молекул. Рассмотрим основные свойства структуры материала:
| Кристаллическая структура | Молекулы вещества могут быть организованы в определенную регулярную структуру, называемую кристаллической. Кристаллический материал характеризуется определенными свойствами, такими как изотропность, твердость, прозрачность и т.д. |
| Аморфная структура | Молекулы вещества могут быть расположены без определенной структуры, что называется аморфной структурой. Аморфные материалы часто обладают другими свойствами, например, высокой пластичностью или прозрачностью. |
| Интермолекулярные взаимодействия | Свойства материала также определяются его межмолекулярными взаимодействиями. В зависимости от типа и силы взаимодействий, вещества могут быть твердыми, жидкими или газообразными. |
| Молекулярная композиция | Молекулярная композиция указывает на тип атомов, составляющих молекулы вещества. Различные атомы могут образовывать разнообразные связи и структуры, что влияет на физические и химические свойства материала. |
Изучение структуры материалов и их свойств является важной областью науки и технологии и позволяет разрабатывать новые материалы с улучшенными характеристиками и применениями.



