Хлор, химический элемент с атомным номером 17, известен своей высокой реактивностью и способностью образовывать химические связи с другими элементами. Однако, несмотря на свою высокую электроотрицательность, хлор имеет валентность 1, а не 7, как могло бы показаться на первый взгляд.
Валентность хлора определяется его электронной конфигурацией. Хлор имеет семь электронов в своей внешней оболочке, что в принципе позволяет ему образовывать 7 ковалентных связей. Однако, электронная конфигурация хлора такова, что образование 7 связей становится энергетически нестабильным процессом.
Кроме того, для образования 7 связей хлору необходимо получить от других элементов по одному электрону, что требует значительной энергии, и затруднено из-за его высокой электроотрицательности. Вместо этого, хлор предпочитает образовывать однонаправленные связи с другими элементами, что означает передачу одного электрона от хлора к другому элементу.
Таким образом, хлор образует связи с другими элементами, обеспечивая себе стабильную валентность 1. Понимание этого особенного свойства хлора позволяет более точно предсказывать его химическую активность и его роль в различных химических реакциях.
Валентность хлора: почему она равна 1 и не 7

Валентность элемента характеризует его способность образовывать химические связи. Для большинства элементов валентность соответствует их электроотрицательности, то есть способности притягивать электроны к себе.
Хлор является одним из таких элементов, у которого валентность может вызывать путаницу. По расположению в периодической системе хлор находится во второй группе элементов, что означает, что у него должна быть валентность 2. Однако, на практике хлор обычно образует соединения, в которых его валентность составляет 1.
Почему же так происходит? Ответ состоит в электронной конфигурации хлора. У хлора в его нейтральном состоянии (без заряда) наружный электронный слой содержит 7 электронов. Из них 2 электрона могут быть переданы другому элементу в химической связи, образуя ион с зарядом -1.
Таким образом, хлор, имея валентность 1, с легкостью образует соединения с другими элементами. Важно отметить, что хлор может также образовывать соединения с валентностью 3, 5 и 7, но это более редкие случаи, которые могут быть объяснены через электронную конфигурацию и особенности образования химических связей.
Итак, валентность хлора равна 1 в большинстве его соединений из-за его электронной конфигурации и способности передать один электрон при образовании химической связи.
Исторические аспекты

История открытия и исследования валентности хлора имеет курьезные и занимательные факты. Впервые валентность была введена в научные обороты в середине XIX века, когда химики стали искать объяснение для явления, известного как сила притяжения атомов друг к другу.
Противоречивая ситуация возникла, когда хлор был открыт в 1774 году шведским химиком Карлом Шеле, который предположил, что хлор имеет валентность 1. Это значит, что хлор имеет только один валентный электрон и может образовывать связь только с одним атомом другого элемента.
Однако, некоторые исследователи не согласились с этим утверждением и считали, что хлор имеет валентность 7, так как на его электронной оболочке есть 7 электронов и, следовательно, может образовывать связь с 7 атомами других элементов.
Таким образом, исторические аспекты исследования валентности хлора являются интересным примером развития научных представлений и принятия новых концепций в химии.
Электронная конфигурация хлора

Электронная конфигурация хлора можно представить следующим образом: [Ne] 3s2 3p5. Такая запись означает, что внутренняя оболочка хлора, аналогичная конфигурации неона (Ne), имеет 10 электронов. Оставшиеся 7 электронов располагаются на более внешней оболочке.
Внешняя оболочка хлора состоит из трех энергетических уровней: 3s, 3px и 3py. Из них, электронная конфигурация указывает, что два электрона расположены на уровне 3s, а остальные пять электронов - на уровнях 3px и 3py.
Такое распределение электронов на внешней оболочке определяет валентность хлора, равную 1. Она указывает, что атом хлора имеет 1 валентный электрон, который может участвовать в химических реакциях и образовывать соединения с другими атомами.
Важно отметить, что хлор имеет возможность получить не только 1 валентный электрон, но и 7 электронов, что соответствовало бы полной оболочке и стабильной электронной конфигурации. Однако, для этого требуется значительное энергетическое вложение, что делает такую реакцию маловероятной и малоэффективной.
Химические свойства хлора
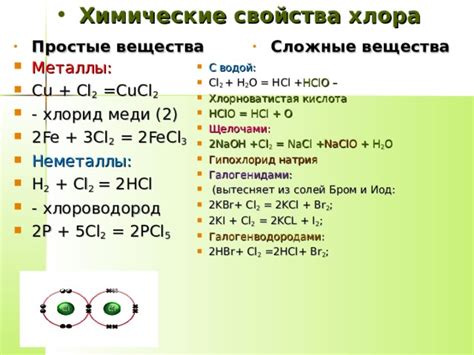
Одним из наиболее известных свойств хлора является его окраска веществ в желто-зеленый цвет. Благодаря этому свойству хлор используется, например, в качестве пищевого красителя и воздушного противогаза.
Хлор также обладает сильными окислительными свойствами. Он способен окислять многие органические и неорганические вещества, что делает его полезным в химии и промышленности.
Важной особенностью хлора является его способность образовывать сольные соединения и ионные связи. Например, хлор может образовывать хлориды с металлами и другими элементами, такими как натрий, калий и магний.
Интересно, что хлор обладает также высоким антисептическим свойством. Благодаря этому его активно используют в медицине и санитарии для дезинфекции воды, убивания бактерий и очистки бассейнов.
Химические свойства хлора делают его важным и неотъемлемым компонентом в различных сферах нашей жизни.
Сравнение с другими галогенами

Однако, в отличие от остальных галогенов, валентность хлора равна 1. Во всех других галогенах валентность равна 1, 3, 5 или 7. Хлор имеет валентность 1, так как он имеет наименьшую электроотрицательность среди галогенов.
Благодаря своей низкой электроотрицательности, хлор проявляет выраженные окислительные свойства и способен образовывать соединения со многими элементами.
Хлор также обладает высокой реактивностью и используется во многих промышленных процессах, а также в производстве многих химических веществ. Вот почему хлор является одним из наиболее распространенных элементов в природе и имеет широкое применение в различных отраслях науки и промышленности.
Роль хлора в органической химии

1. Антибактериальное действие. Хлор используется в качестве основного компонента в процессе обеззараживания воды, поскольку он эффективно уничтожает бактерии и другие вредные микроорганизмы. Без хлора было бы затруднительно обеспечить безопасное потребление питьевой воды.
2. Синтез органических соединений. Хлор используется в органическом синтезе для получения различных веществ, таких как пластик, полимеры и органические реагенты. Он может быть использован в качестве реагента в различных химических реакциях, включая замещение атомов в органических молекулах.
3. Хлорирование органических соединений. Хлор используется для внесения хлорных атомов в молекулы органических соединений, что может привести к изменению их свойств. Такие реакции могут улучшить устойчивость соединений к разрушению, увеличить их срок службы и обладать другими полезными свойствами.
4. Стабилизация полимеров. Хлорированные соединения могут быть использованы для стабилизации полимеров, что значительно повышает их устойчивость к воздействию окружающей среды и увеличивает их срок службы. Также, добавление хлора может улучшить некоторые физические и механические свойства полимеров.
Таким образом, хлор играет важную роль в органической химии, обеспечивая многочисленные применения в процессах синтеза, модификации и стабилизации органических соединений. Его уникальные свойства делают его незаменимым компонентом в различных областях промышленности и научных исследований.



