Тело человека, как и любого другого живого организма, состоит из молекул. Эти микроскопические частицы связаны между собой сильными силами притяжения, образуя ткани, органы и системы. Подобно тому, как крепко стягиваются магниты или притягиваются между собой обладатели противоположных полов, молекулы в нашем теле взаимодействуют и создают основу для жизнедеятельности.
Притяжение между молекулами, известное как межмолекулярные силы, стабилизирует атомы и молекулы, позволяя им образовывать устойчивые структуры. Слабые силы притяжения, такие как ван-дер-ваальсовы силы или дипольные взаимодействия, играют важную роль в формировании свойств многих веществ. К примеру, благодаря межмолекулярным силам вода остается жидкой и способна кипеть и замерзать при определенных температурах.
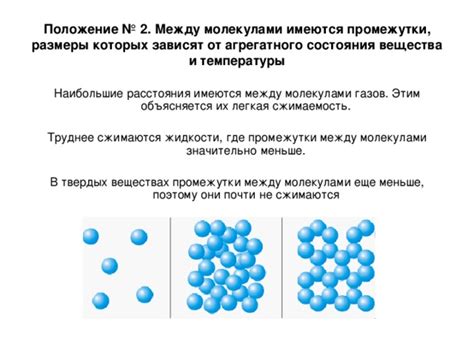
Однако, помимо притяжения, важную роль играют и промежутки между молекулами. Именно благодаря им тело человека обладает свойством притягивать вещества, полезные для его функционирования, и отталкивать вредные. Например, воздух, находящийся между молекулами в наших легких, позволяет нам дышать и поставлять кислород в организм, а слишком плотные вещества не могут проникать внутрь наших клеток и оказывать на них негативное воздействие. Таким образом, промежутки между молекулами имеют ключевое значение для правильной работы нашего организма.
Сила притяжения: взаимодействие между молекулами и их промежутками

Сила притяжения между молекулами и их промежутками играет ключевую роль в различных физических и химических процессах. Она определяет свойства вещества, его состояние и способность к образованию связей.
Притяжение между молекулами обусловлено действием электростатических сил, взаимодействием дипольных моментов и ван-дер-ваальсовыми взаимодействиями.
- Электростатические силы возникают в результате взаимодействия зарядов молекул. Полярные молекулы, имеющие неравномерное распределение заряда, создают электрическое поле, притягивающее другие молекулы.
- Взаимодействие дипольных моментов происходит в случае, когда одна молекула обладает постоянным дипольным моментом, а другая – индуцированным. Полярность молекул определяет силу взаимодействия.
- Ван-дер-ваальсовы взаимодействия являются слабыми притяжениями между молекулами. Они обусловлены временными флуктуациями электронного облака, создающими моментарные диполи. В результате, молекулы притягиваются друг к другу.
Величина и характер притяжения между молекулами зависит от типа и структуры вещества. Водородные связи, являющиеся одним из видов электростатических сил, обусловливают особые свойства веществ, такие как высокая температура кипения воды.
Взаимодействие между молекулами и их промежутками влияет на фазовые переходы, силу поверхностного натяжения, вязкость, теплопроводность и другие характеристики вещества.
Исследование сил притяжения между молекулами и их промежутками позволяет лучше понять природу вещества и использовать эту информацию для разработки новых материалов и технологий.
Молекулы: строительные блоки вещества
Молекулы состоят из атомов, которые соединяются между собой с помощью химических связей. Каждая молекула имеет свою уникальную структуру, которая определяет ее химические и физические свойства. Например, молекулы воды состоят из атомов кислорода и водорода, а молекулы углекислого газа - из атомов углерода и кислорода.
Молекулы могут быть представлены в виде трехмерных моделей, таких как шариково-палочные модели или модели "шары и палки". Эти модели помогают нам визуализировать и понять, как молекулы устроены и как они взаимодействуют друг с другом.
В чистом виде молекулы часто существуют в газообразной, жидкой или твердой форме. Например, вода в газообразном виде - это пар, в жидком виде - это вода, в твердом виде - это лед. Изменение условий, таких как температура и давление, может привести к изменению состояния молекул и, следовательно, вещества.
Особенностью молекул является их способность взаимодействовать друг с другом. Молекулы могут притягивать друг друга силой, называемой ван-дер-ваальсовой силой, и образовывать различные структуры, такие как сетки или сгустки. Эти взаимодействия играют важную роль в таких феноменах, как смешивание жидкостей, растворение веществ и образование кристаллов.
В итоге, понимание молекул и их взаимодействий имеет большое значение для научных исследований, а также практических приложений в различных областях, таких как фармацевтика, материаловедение и энергетика.
Промежутки между молекулами: открытая сетка
Молекулы вещества не находятся в постоянном контакте друг с другом, они находятся на определенном расстоянии и образуют промежутки между собой. В некоторых случаях эти промежутки могут быть значительными и образовывать открытую сетку.
Открытая сетка - это структура вещества, в которой между молекулами существуют значительные промежутки. Эти молекулы находятся в конкретных позициях и взаимодействуют друг с другом через слабые силы притяжения.
Промежутки в открытых структурах могут быть заполнены другими молекулами или частицами. Это позволяет сохранять структурную целостность и свойства вещества. Примерами открытых сеток являются кристаллические структуры, губки и многие другие материалы.
Открытые сетки обладают рядом уникальных свойств. Их промежутки могут быть заполнены различными гостевыми молекулами, что делает их полезными для различных приложений, таких как сорбция и хранение газов. Также открытые сетки имеют большую поверхность, что обеспечивает высокую активность в химических реакциях.
Исследование и понимание открытых сеток имеет большое значение для различных областей науки и технологии, таких как материаловедение, катализ и мембранные технологии. Изучение взаимодействия молекул и промежутков между ними позволяет разрабатывать новые материалы с уникальными свойствами и применением.
Притяжение между молекулами: сила, поддерживающая вещество вместе

Один из основных видов притяжения между молекулами - ван-дер-ваальсово взаимодействие. Это слабая сила, которая действует между неполярными молекулами, такими как молекулы газов и неорганических соединений. Ван-дер-ваальсово взаимодействие возникает из-за небольшого временного нежелательного распределения электронной плотности в молекуле, что приводит к небольшому смещению зарядов и созданию временного диполя. Эти временные диполи взаимодействуют с другими молекулами, приводя к образованию слабых притяжений.
Еще одним видом притяжения между молекулами является водородная связь. Водородные связи возникают между молекулами, содержащими атомы водорода, связанные с атомами других элементов: кислорода, азота или фтора. Водородные связи являются одними из наиболее сильных межмолекулярных сил и играют важную роль во многих физических и химических процессах. Например, водородные связи обеспечивают уникальные свойства воды, такие как высокая температура кипения и плотность в сравнении с другими жидкостями.
Также существуют другие виды притяжения между молекулами, такие как дисперсное взаимодействие и ионно-дипольное взаимодействие. Дисперсное взаимодействие возникает между молекулами, имеющими постоянный момент диполя или полидиполя, и является результатом неравномерного распределения электронной плотности. Ионно-дипольное взаимодействие возникает между ионом и молекулой, имеющей дипольный момент. Эти виды притяжения также играют важную роль во многих процессах, таких как растворение веществ или выпадение осадков.
Все эти межмолекулярные силы вместе обеспечивают прочность и стабильность вещества. Они позволяют молекулам притягиваться друг к другу и образовывать твердые, жидкие или газообразные состояния. Благодаря этим силам, мы можем наслаждаться разнообразием свойств материалов и использовать их во многих сферах нашей жизни.
Взаимодействие молекул в газах: диффузия и атмосферное давление

Молекулы вещества распространяются в пространстве за счет случайного движения. Они сталкиваются между собой, а также со стенками сосуда или преградой. В результате столкновений молекулы меняют направление своего движения. Это явление называется диффузией.
Диффузия играет важную роль в природе. Она позволяет распространяться аромату воздуха, смешивать вещества в растворах и осуществлять обмен веществ между клетками организмов.
Атмосферное давление - это сила, которую воздушные молекулы оказывают на поверхность, находящуюся под действием гравитационного поля Земли.
При рассмотрении молекулярной природы газов атмосферное давление может быть объяснено следующим образом. Молекулы газа постоянно движутся в разных направлениях и со случайными скоростями. При столкновении с поверхностью объекта, молекулы передают ему некоторый импульс, создавая давление.
Атмосферное давление изменяется с высотой над уровнем моря. В верхних слоях атмосферы плотность молекул воздуха ниже, что приводит к уменьшению давления. Поэтому на больших высотах, например, на горных вершинах, атмосферное давление меньше, чем на уровне моря.
Исследование взаимодействия молекул в газах и атмосферного давления позволяет лучше понять природу и свойства различных веществ. Диффузия и атмосферное давление играют важную роль в таких областях, как физика, химия, медицина и технические науки.
Взаимодействие молекул в жидкостях: поверхностное натяжение и капиллярное действие

Поверхностное натяжение имеет большое практическое значение, так как оно определяет форму жидкой поверхности и ее способность формировать капли, пузырьки и пленки. Это свойство позволяет жидкостям существовать в определенном объеме и поддерживать взаимодействие со своим окружением.
Капиллярное действие, или капиллярность, это способность жидкости проникать в узкую щелочку или тонкую трубку, возникающая из-за поверхностного натяжения и взаимодействия с непроницаемыми для жидкости поверхностями. Капиллярное действие объясняет, например, почему вода взбирается вверх в узких каналах или почвенных порах.
Взаимодействие молекул в жидкостях, проявляющееся через поверхностное натяжение и капиллярное действие, находит применение во многих областях: от промышленности и биологии до кулинарии и медицины. Понимание этих явлений позволяет лучше понять молекулярную природу жидкостей и использовать их свойства для решения различных задач и создания новых технологий.
Взаимодействие молекул в твердых веществах: кристаллическая структура и механические свойства
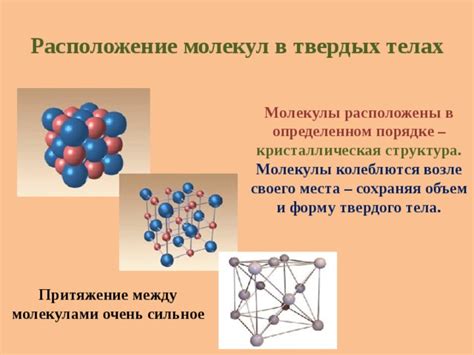
Твердые вещества состоят из атомов или молекул, которые взаимодействуют друг с другом, образуя кристаллическую структуру. Кристаллическая структура характеризуется определенным порядком расположения атомов или молекул, который обуславливает механические свойства твердого вещества.
Взаимодействие молекул в твердых веществах происходит через электростатические силы притяжения и отталкивания между зарядами, которые находятся на атомах или молекулах. Эти силы вызывают образование связей между атомами или молекулами и определяют стабильность и прочность кристаллической структуры.
Кристаллическая структура твердого вещества имеет регулярный повторяющийся узор, состоящий из определенного количества атомов или молекул. Этот узор может быть представлен трехмерной решеткой, в которой каждый узел соединен с определенными соседними узлами. Кристаллическая решетка определяет механические свойства твердого вещества, такие как твердость, прочность и износостойкость.
Механические свойства твердого вещества, определяемые кристаллической структурой, связаны с двумя основными факторами - типом связей между атомами или молекулами и способом их упорядочения в решетке. Например, ковалентные связи между атомами дают высокую прочность и твердость, в то время как слабо связанные молекулы обычно имеют низкую прочность и твердость.
Кроме того, степень упорядоченности решетки также влияет на механические свойства твердого вещества. Чем более регулярно и плотно расположены атомы или молекулы в решетке, тем механически прочнее и тверже будет вещество. Напротив, если атомы или молекулы расположены более хаотично и неупорядоченно, то вещество будет более мягким и деформируемым.
Взаимодействие молекул в твердых веществах и их упорядоченная кристаллическая структура играют важную роль в различных областях, таких как материаловедение, физика, химия и инженерия. Понимание и контроль этих процессов позволяют создавать новые материалы с определенными механическими свойствами и применять их в различных технических и промышленных сферах.
Изучение силы притяжения: экспериментальные методы и теоретические модели

Для измерения величины силы притяжения между молекулами существуют различные экспериментальные методы. Один из них – метод капельного весения, при котором измеряется сила, действующая на каплю жидкости, находящуюся в гравитационном поле. С помощью специальных приборов можно определить силу притяжения между частицами внутри капли.
Другим методом является анализ погрешности массы. Путем взвешивания объектов с известными массами и определением погрешности измерений можно получить данные о силе притяжения между молекулами.
Теоретические модели также помогают понять силу притяжения между молекулами. Одна из таких моделей – модель ван-дер-Ваальса, основанная на представлении о взаимодействии между молекулами через дипольные моменты. Эта модель объясняет особенности атомов и молекул с электрическим и дипольным взаимодействием.
Еще одна теоретическая модель – модель силы притяжения Леннарда-Джонса. Она описывает взаимодействие между неполярными молекулами и учитывает эффекты взаимодействия на различных расстояниях. Эта модель используется для описания реальных систем и предсказания их свойств.
Совместное использование экспериментальных методов и теоретических моделей позволяет получить более точные и полные данные о силе притяжения между молекулами. Это позволяет дальше развивать науку в этой области и использовать ее для решения практических задач в различных сферах, таких как фармакология, материаловедение и промышленность.



