Один из самых значимых элементов в таблице Менделеева – железо. Его символ Fe происходит от латинского слова "Ferrum" и олицетворяет самую важную особенность этого металла – его магнитные свойства. Однако, помимо этого, железо также привлекает внимание особенной конфигурацией электронов на внешнем энергетическом уровне, который называется "n-1d6 ns2" строением.
Почему именно железо имеет 2 электрона на внешнем уровне? Ответ лежит в электронной конфигурации этого элемента. Внешний энергетический уровень состоит из двух подуровней – s- и d-подуровни. Вторжение электронов в эти подуровни наполняет внешний уровень железа электронами. Атом железа имеет 26 электронов, из которых первых 2 электрона находятся в s-подуровне, а именно в его s-орбитали, и образуют закрытую электронную конфигурацию.
Стоит отметить, что "каноническое" d-сверхнаполнение имеет место быть только для вещества в большом количестве и при агрегатном состоянии, и это явление объясняется комплексообразованием по типу Fe(CN)6 3-. Комплексный ион имеет семь внешних электронов, которые заполняют 3d-подуровень. Отсюда и происходит поговорка о наличии комплексообразующей способности у железа.
Почему в железе 2 электрона внешнего уровня?
Химический элемент железо (Fe) находится в 8-м группе периодической таблицы. Внешний энергетический уровень атома железа содержит 2 электрона. Это можно объяснить их электронной конфигурацией.
Электронная конфигурация атома железа: 1s² 2s² 2pˡ 3s² 3p⁶ 4s² 3d⁶
1s² - 2 электрона внутреннего (1s) энергетического уровня.
2s² 2p¹ - 8 электронов на внешнем (2s² 2p¹) энергетическом уровне.
3s² 3p⁶ - 8 электронов на следующем энергетическом уровне.
4s² 3d⁶ - оставшиеся 14 электронов на верхнем энергетическом уровне.
Таким образом, у железа 2 электрона на его внешнем энергетическом уровне, что делает его более стабильным и предсказуемым химическим элементом в химических реакциях.
Структура атома железа
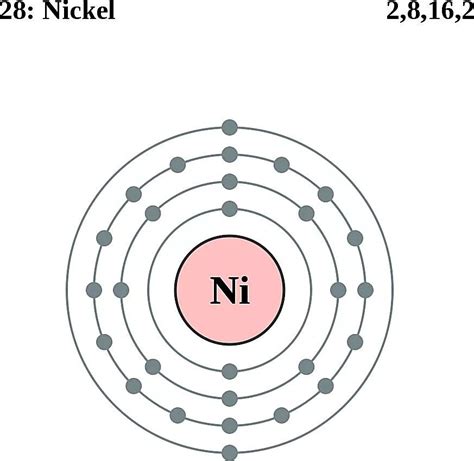
Атом железа (Fe) состоит из ядра, в котором находятся протоны и нейтроны, и облака электронов, движущихся вокруг ядра на энергетических уровнях.
Ядро атома железа содержит 26 протонов, что определяет его атомный номер. Количество нейтронов в ядре может варьироваться, но в обычном атоме железа их также примерно 26. Это обеспечивает электрическую нейтральность атома.
Вокруг ядра атома железа располагаются электронные облака. В этих облаках электроны движутся по орбитам, называемым энергетическими уровнями. Энергетические уровни могут иметь разное количество электронов, а верхний уровень может вместить до 8 электронов.
У атома железа внешний энергетический уровень содержит 2 электрона. Это обусловлено тем, что при заполнении энергетических уровней электроны стремятся занять максимально возможное количество подуровней и обладать минимальной энергией.
Из двух электронов на внешнем уровне один электрон занимает s-подуровень, а второй электрон занимает p-подуровень. Это подтверждает распределение электронов по энергетическим уровням в атоме железа.
Особенности электронной конфигурации

Железо (Fe) имеет атомный номер 26, что означает, что у него 26 электронов. По распределению электронов по энергетическим уровням, электронная конфигурация железа может быть представлена как:
- 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Первые два электрона располагаются на первом энергетическом уровне (1s2), следующие восемь электронов занимают второй энергетический уровень (2s2 2p6), а оставшиеся шестнадцать электронов занимают третий и четвёртый энергетические уровни (3s2 3p6 4s2 3d6).
Особенность электронной конфигурации железа заключается в том, что на его внешнем энергетическом уровне (четвёртом) находятся два электрона. Данный уровень, известный как "d-подуровень", может вместить до десяти электронов, однако в случае железа он заполнен лишь наполовину. Это происходит из-за особенностей электронного строения атомов ионов d-блока таблицы Менделеева.
Атомы железа обычно стремятся завершить внешний энергетический уровень путём приёма или отдачи двух электронов. Это подтверждает и наблюдаемый факт о наличии двух электронов на внешнем уровне в железе. Так же, наличие двух электронов на внешнем уровне делает железо неполным d-блоком переходных металлов.
Энергетические уровни и подуровни
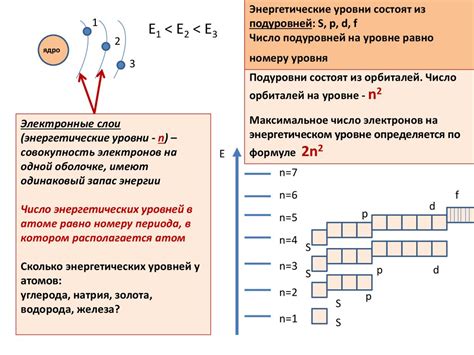
Электроны располагаются на энергетических уровнях, которые называются K, L, M и т.д. Уровни расположены от самого близкого к ядру до самого удаленного. Энергетический уровень K имеет наиболее низкую энергию, а последующие уровни имеют все более высокую энергию.
Каждый энергетический уровень делится на подуровни, которые обозначаются буквами s, p, d, f и т.д. Количество подуровней определяется номером уровня. Например, на уровне K находится только один подуровень s, на уровне L - s и родственные подуровни p. На уровних M и N - s, p и d подуровни.
Конфигурация электронов в железе

На самом внешнем энергетическом уровне, который является 4-м по счету, находятся 2 электрона. Этот уровень называется 3d-подуровнем. Каждый подуровень может содержать до 10 электронов, но в случае железа на 3d-подуровне находятся всего 2 электрона.
Это объясняется электронной конфигурацией железа, которая имеет вид [Ar] 3d^6 4s^2. В квадратных скобках указана электронная конфигурация аргония, предыдущего элемента в таблице, у которого все энергетические уровни заполнены до s-подуровня. Затем следует описание рассматриваемого элемента - железа.
Поэтому, хотя на 4s-подуровне могло бы быть 6 электронов, на самом деле там находятся только 2 электрона, а оставшиеся 4 электрона заполнили 3d-подуровень. Это объясняет наличие 2 электронов на внешнем энергетическом уровне железа.
Химические свойства железа

1. Окисление и восстановление:
Железо может претерпевать окисление и восстановление в различных химических реакциях. Окисление железа приводит к образованию оксида железа (FeO) или гидроксида железа (Fe(OH)2), а восстановление - к образованию элементарного железа или его соединений с низкой степенью окисления.
2. Коррозия:
Железо подвержено коррозии при взаимодействии с водой и кислородом. В результате коррозии на поверхности железа может образоваться ржавчина, которая снижает эффективность и прочность материала.
3. Соединения:
Железо может образовывать множество соединений, включая железные соли (например, хлорид железа, FeCl2 или FeCl3) и органические соединения железа (например, гемоглобин в крови).
4. Катализатор:
Железо является важным катализатором во многих химических реакциях, включая превращение аммиака в нитраты в почве и превращение водорода и оксида углерода в метан в процессе производства синтетического газа.
5. Магнитные свойства:
Железо обладает высокой магнитной пермеабельностью и является основным компонентом магнитных материалов, таких как железо и сталь.
В целом, химические свойства железа делают его важным элементом во многих промышленных, технических и биологических процессах.
Значение электронной конфигурации для свойств вещества
Электронная конфигурация атома играет важную роль в определении его свойств и химического поведения. В случае железа, электронная конфигурация с двумя электронами на внешнем энергетическом уровне имеет свое значение.
Электронная конфигурация элемента определяется расположением его электронов в атоме. Каждый энергетический уровень может вмещать определенное количество электронов. В случае железа, атом имеет общую электронную конфигурацию [Ar] 3d6 4s2, где [Ar] обозначает электронную конфигурацию аргона и числа после d и s показывают, сколько электронов находятся на соответствующих уровнях.
На внешнем энергетическом уровне железа находятся два электрона, обозначаемые как 4s2 - это самый высокий доступный энергетический уровень в атоме железа. Эти два электрона на внешнем уровне влияют на свойства железа и его химическое поведение.
Электроны на внешнем энергетическом уровне обычно определяют вещественные свойства элемента, такие как его способность вступать в химические реакции или образовывать соединения с другими элементами. У железа эти два электрона в 4s2 подвержены взаимодействию с окружающими элементами и окружающей средой, что в конечном итоге определяет его химическую активность и свойства.
| Энергетический уровень | s-подуровень | p-подуровень | d-подуровень |
|---|---|---|---|
| 1 | |||
| 2 | |||
| 3 | 6 | ||
| 4 | 2 |
Искусственное изменение электронной конфигурации

Например, для железа, которое имеет 2 электрона на внешнем энергетическом уровне, его электронную конфигурацию можно изменить, добавив или удалив электроны на этом уровне. Это можно сделать с помощью процесса ионизации или образования комплексов.
Ионизация железа может привести к образованию железо(II) и железо(III) ионов. Железо(II) ион имеет электронную конфигурацию [Ar] 3d6, а железо(III) имеет конфигурацию [Ar] 3d5. Таким образом, добавление или удаление электрона приводит к изменению электронной конфигурации и химическим свойствам железа.
Такие изменения электронной конфигурации могут быть использованы в различных областях, например, в катализе или создании новых материалов с определенными свойствами. Понимание процессов искусственного изменения электронной конфигурации элементов помогает улучшить понимание и контроль над химическими реакциями и созданием новых материалов.
Применение железа в научных и технических сферах
Одной из самых известных областей применения железа является строительство и инженерия. Железо используется для создания каркасов зданий, мостов, трубопроводов и других инженерных конструкций. Благодаря высокой прочности и устойчивости к коррозии, железо обеспечивает долговечность и надежность таких конструкций.
Кроме того, железо широко применяется в автомобильной промышленности. Большая часть автомобильных деталей, включая двигатели, кузовы и тормозные системы, изготавливаются из железа. Благодаря его прочности и дешевизне, железо является оптимальным материалом для автомобильных производителей.
Железо также широко применяется в энергетической отрасли. Оно является основным компонентом стальных конструкций электрических столбов и башен. Благодаря высокой проводимости электричества, железо также используется для создания магнитных ядер в генераторах и трансформаторах.
Научные исследования ядерной физики также используют железо в качестве материала для создания ядерных реакторов и установок. Железо обладает высокой изотопной устойчивостью и может выдерживать высокие температуры и давления, что делает его идеальным материалом для ядерной энергетики.
| Область применения | Примеры применения |
|---|---|
| Строительство и инженерия | Каркасы зданий, мосты, трубопроводы |
| Автомобильная промышленность | Двигатели, кузовы, тормозные системы |
| Энергетика | Стальные конструкции, магнитные ядра |
| Ядерная физика | Ядерные реакторы, установки |
Железо играет важную роль в научных и технических сферах благодаря своим уникальным свойствам. Его высокая прочность, устойчивость к коррозии, хорошая проводимость электричества и способность выдерживать высокие температуры делают его неотъемлемым материалом в различных отраслях.



