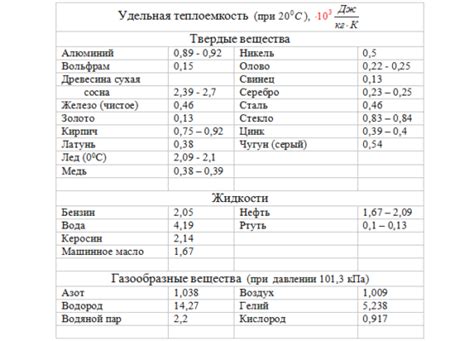
Удельная теплоемкость вещества - это физическая характеристика, которая показывает, сколько энергии необходимо затратить, чтобы нагреть единицу массы данного вещества на один градус Цельсия. Вода и лед, несмотря на то, что являются разными состояниями одного и того же вещества, имеют различные значения удельной теплоемкости.
Вода - это исключительная вещество. Она обладает высокой удельной теплоемкостью, то есть для ее нагревания требуется значительное количество энергии. Это происходит из-за особенностей водной структуры. Атомы водорода и кислорода, образующие молекулу воды, связаны между собой не только обычными ковалентными связями, но и водородными связями, которые воздействуют на структуру и свойства воды.
Когда вода нагревается, энергия преобразуется в движение молекул, которое приводит к нарушению водородных связей между молекулами воды. Это означает, что требуется значительное количество энергии, чтобы разрушить эти связи и повысить температуру воды. Именно эти дополнительные водородные связи объясняют высокую удельную теплоемкость воды.
Причины различий в удельной теплоемкости у льда и воды
Структурные особенности льда – одна из наиболее существенных причин различий в удельной теплоемкости. Лед имеет кристаллическую структуру, в которой молекулы воды упорядочены в виде регулярной решетки. Вследствие этого, при нагреве леда часть энергии тратится на разрушение связей между молекулами, что затрудняет нагревание и, соответственно, повышает удельную теплоемкость льда.
Изменение агрегатного состояния – еще одна важная причина различий. Для перехода из твердого состояния (льда) в жидкое (воды) необходимо поглотить определенное количество теплоты, которое называется удельной теплотой плавления. И наоборот, при замерзании вода отдает определенное количество тепла. Следовательно, чтобы изменить агрегатное состояние, нужно затратить или получить дополнительную энергию, что влияет на удельную теплоемкость воды и льда.
Разница в свободном движении молекул – еще один фактор, влияющий на значения удельной теплоемкости. Вода в жидком состоянии имеет большую свободу движения молекул, что способствует более интенсивному обмену энергией с окружающей средой. Лед, в свою очередь, имеет более упорядоченную структуру, что затрудняет перемещение молекул и обмен энергией, что автоматически повышает удельную теплоемкость льда по сравнению с водой.
Взаимодействие электрических диполей – еще одна причина различий в удельной теплоемкости. Молекулы воды обладают электрическим диполем, что вызывает взаимодействие между ними. В ледяной решетке электрические диполи молекул воды ориентированы в определенном порядке, что затрудняет взаимодействие с окружающими молекулами и увеличивает удельную теплоемкость льда.
Молекулярная структура вещества
Удельная теплоемкость вещества определяется его молекулярной структурой. Вода и лед состоят из молекул, представляющих собой соединения атомов кислорода и водорода. Вода в жидком состоянии имеет молекулярную структуру, где молекулы двигаются и вращаются, образуя связи между собой. Каждая молекула воды имеет электрический диполь, что создает притяжение между молекулами. Это обуславливает силу взаимодействия и протекающие процессы, такие как конденсация и испарение.
Лед имеет кристаллическую структуру, в которой молекулы воды упорядочены в решетку. Каждая молекула воды во льду тесно связана с соседними молекулами посредством водородных связей. Это делает лед более плотным и упорядоченным, чем жидкая вода.
Различия в молекулярной структуре воды и льда приводят к различиям в их удельной теплоемкости. Удельная теплоемкость воды выше, чем удельная теплоемкость льда, из-за большей свободы движения молекул в разжиженной структуре жидкости. Чтобы нагреть молекулы воды, требуется больше энергии, чем для нагрева молекул льда. Таким образом, вода может поглощать и отдавать больше тепла, чем лед, что существенно влияет на ее физические свойства и использование в различных процессах и системах.
Водородные связи
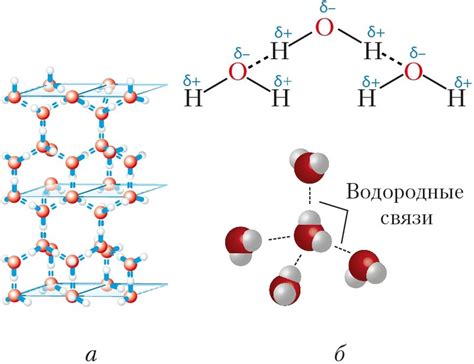
Водородные связи возникают из-за особенностей строения молекулы воды. В молекуле воды атом кислорода связан с двумя атомами водорода. Атому кислорода не хватает электронов, чтобы удовлетворить его восемьэлектронной октаэдрической структуре, поэтому молекула образует водородную связь.
Водородная связь формируется благодаря сильному притяжению избыточно заряженного атома кислорода одной молекулы к атомам водорода соседних молекул. Это приводит к образованию сетки водородных связей во взаимодействующих частицах воды.
Водородные связи имеют большую энергию, поэтому при нагревании вещества, эти связи сложно разрушаются. Водородные связи в молекуле воды делают ее более устойчивой и способной поглощать больше энергии при нагревании. Именно поэтому удельная теплоемкость воды выше, чем у льда.
Возможность образования водородных связей также увеличивает плотность воды. В момент замерзания, водные молекулы организуются в определенную кристаллическую структуру, образуя сеть сильных связей. Такие структуры занимают больше места в объеме, что приводит к увеличению объема и снижению плотности льда по сравнению с жидкой водой.
Различия в плотности

Таким образом, из-за различий в плотности льда и воды, при нагревании, сначала лед начинает плавиться, превращаясь в воду. Этот процесс требует большего количества энергии для нагревания единицы массы вещества, чем простое повышение температуры уже существующей жидкой воды.
Такое поведение обуславливается легко испаряемостью воды и важно для поддержания жизни на Земле. Благодаря этому, вода в озерах и реках, а также в мировом океане, разогревается не равномерно, что позволяет поддерживать более стабильную температуру в местах обитания различных организмов.



