Кипение - это физический процесс, при котором жидкость превращается в пар при достижении определенной температуры. Эта температура называется температурой кипения. Но мало кто задумывается о том, что температура кипения может меняться в зависимости от внешнего давления.
Внешнее давление оказывает влияние на температуру кипения из-за его воздействия на пары вещества. Пары могут оказывать давление на окружающую среду, и внешнее давление противодействует испарению. Если внешнее давление равно атмосферному, то температура кипения будет равна обычной, называемой также точкой кипения.
Однако, изменение внешнего давления может привести к изменению температуры кипения. При увеличении внешнего давления температура кипения повышается, а при уменьшении - снижается. Это объясняется изменением равновесия и взаимодействием между частицами жидкости и паров. Именно поэтому в горных районах вода кипит при более низкой температуре, чем на уровне моря.
Влияние внешнего давления на температуру кипения

Когда внешнее давление увеличивается, температура кипения также повышается. Это связано с изменением условий, при которых происходит переход молекул жидкости в газообразное состояние. Под действием внешнего давления, увеличивается сила, с которой молекулы жидкости сталкиваются друг с другом, что затрудняет их выход в газовую фазу. В результате, молекулы жидкости должны обладать большей энергией, чтобы преодолеть эту силу и перейти в газовую фазу. Поэтому, при повышении внешнего давления, температура кипения жидкости увеличивается, чтобы обеспечить необходимое количество энергии для возникновения перехода.
Также следует отметить, что изменение внешнего давления может привести к изменению температурного интервала, в котором происходит кипение вещества. При повышении давления, температура кипения увеличивается, а при понижении - уменьшается. Это связано с изменением баланса между давлением, при котором молекулы жидкости переходят в газовую фазу, и их кинетической энергией. При повышении давления, необходимо больше энергии для перехода молекул в газовую фазу, поэтому температура кипения должна быть выше.
Изменение внешнего давления может иметь практическое применение. Например, в кулинарии использование высокого давления в специальных качественных котлах позволяет приготовить пищу при более низких температурах, сэкономив время и сохраняя больше питательных веществ в продуктах.
| Внешнее давление | Температура кипения |
|---|---|
| Высокое | Повышается |
| Низкое | Уменьшается |
Как давление воздействует на температуру изменения фазы вещества

Совокупность молекул вещества стремится находиться в равновесии. Когда вещество находится в жидком состоянии, его молекулы имеют относительно близкую плотность и находятся под внешним давлением. При повышении давления на вещество, межмолекулярные силы увеличиваются, что приводит к увеличению температуры кипения. Обратно, при уменьшении давления, межмолекулярные силы снижаются, что приводит к уменьшению температуры кипения.
Теория кинетической энергии помогает объяснить этот эффект. При повышении давления, межмолекулярные силы стимулируют образование более устойчивых связей между молекулами, что требует большей энергии для разрыва связей и перехода в газообразное состояние. Следовательно, температура кипения повышается.
Однако, не все вещества реагируют на давление одинаково. Некоторые вещества имеют слабые межмолекулярные силы, а значит, давление оказывает незначительное влияние на их температуру кипения. Для других веществ постоянное давление может быть критическим для возникновения фазового перехода.
Важно отметить, что изменение давления также может влиять на подавление или повышение количества испаряемых молекул, что может привести к изменению скорости испарения и температуры кипения. Это наблюдается при приготовлении пищи на больших высотах, где атмосферное давление ниже, что приводит к снижению температуры кипения воды.
Физические основы зависимости температуры кипения от давления
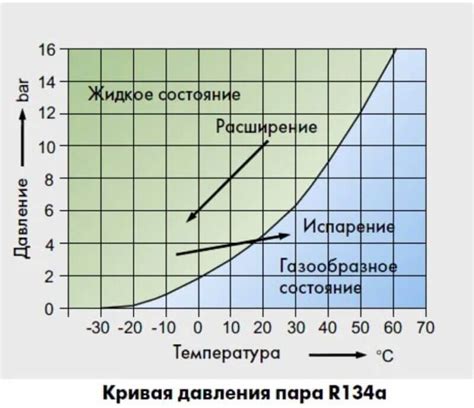
Для объяснения этой зависимости важно понимать, что кипение – это процесс перехода вещества из жидкого состояния в газообразное при достижении определенной температуры и давления, известной как температура кипения. В молекулярно-кинетической теории объясняется, что вещество состоит из молекул, которые постоянно движутся и взаимодействуют друг с другом.
Когда внешнее давление увеличивается, воздействие на жидкость или раствор усиливается, поскольку давление создает внешнюю силу, противодействующую силе внутренней молекулярной деятельности. Молекулы жидкости начинают бороться с этой силой, а если внешнее давление становится достаточно велико, молекулам становится сложнее преодолеть внешнюю силу и переходить в газообразное состояние.
Следовательно, при повышении давления точка кипения вещества повышается, так как молекулам требуется больше энергии, чтобы побороть внешнюю силу и перейти в газообразное состояние. В то же время, при понижении давления, молекулам становится легче преодолеть внешнюю силу, и точка кипения снижается.
Кроме того, следует отметить, что зависимость температуры кипения от давления может быть разной для различных веществ. Некоторые вещества, такие как вода, имеют более высокую зависимость, в то время как другие, например, спирт, имеют более низкую зависимость. Это связано с различными свойствами молекул и межмолекулярных сил вещества.
Таким образом, понимание физических основ зависимости температуры кипения от давления является важным для многих областей науки и технологии, включая химию, физику, биологию, медицину и промышленность. Изучение этой зависимости помогает установить правильные условия для различных процессов и экспериментов, а также позволяет получить желаемый результат при работе с различными веществами.
Практическое применение знаний о зависимости температуры кипения от давления
Знание о зависимости температуры кипения от давления имеет широкое практическое применение в различных областях науки и промышленности.
Одним из примеров применения этого знания является процесс дистилляции. Дистилляция - это метод разделения жидкостей на компоненты с различными температурами кипения. В процессе дистилляции жидкость нагревается и испаряется, а затем сконденсированные пары собираются и разделяются на компоненты. Знание о зависимости температуры кипения от давления позволяет контролировать процесс дистилляции и достичь нужной степени разделения компонентов.
Другим применением этого знания является процесс приготовления пищи. При варке пищи вода играет важную роль. Варка яиц, пасты, риса и других продуктов требует точного контроля температуры. Знание о зависимости температуры кипения от давления позволяет достичь нужной степени готовности продукта и сохранить его вкус и питательные свойства.
Применение этого знания можно найти и в области химической промышленности. Некоторые химические процессы требуют определенной температуры для реакции или для извлечения продукта. Регулирование давления позволяет контролировать температуру кипения и, соответственно, управлять процессом химической реакции.
Таким образом, знание о зависимости температуры кипения от давления имеет значительное практическое значение в различных областях и позволяет улучшить процессы разделения, приготовления пищи и химических реакций.



