Циклоалканы - это органические соединения, в которых головная цепь состоит из атомов углерода, образующих замкнутый цикл. У алканов же головная цепь представляет собой прямую или ветвистую последовательность углеродных атомов.
Одним из основных факторов, определяющих разницу в температуре кипения между циклоалканами и алканами, является их структура. Кольцевая структура циклоалканов обуславливает большую плотность молекулярной упаковки, что приводит к сильным межмолекулярным взаимодействиям между молекулами. Эти взаимодействия требуют большего количества энергии для разрушения связей и перехода в газовую фазу.
Кроме того, у циклоалканов могут быть π-электроны на своих кольцевых системах. Данные π-электроны обладают электроными всевозможностями для образования π-связей. Поэтому, чтобы испарить циклоалкан и перевести его в газообразное состояние, требуется дополнительная энергия.
Структура молекул
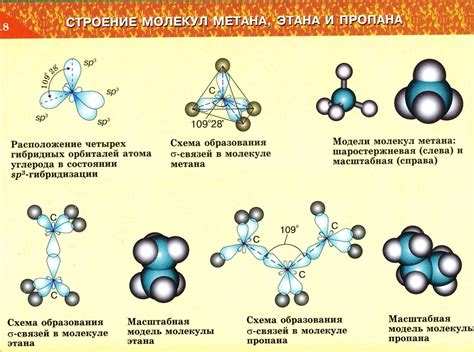
Циклоалканы состоят из закольцованных цепей углеродных атомов, где на каждом атоме углерода присоединены два атома водорода и два атома углерода (кроме краевых атомов). Такая структура образует плоский кольцевой граф, и молекулы циклоалканов могут принимать как круглую, так и кеглевидную форму.
В алканах, напротив, углеродные атомы образуют прямую цепь, присоединенную к атомам водорода. Молекулы алканов образуют длинные цепочки, которые могут быть прямыми или ветвистыми.
Из-за своей кольцевой структуры, молекулы циклоалканов имеют более высокую плотность, чем молекулы алканов. Более плотная структура влияет на силы ван-дер-ваальса – слабые силы, удерживающие молекулы вещества вместе. Чем больше сил ван-дер-ваальса, тем выше температура кипения.
Кроме того, из-за кольцевой структуры, молекулы циклоалканов имеют меньше свободных электронов для образования межмолекулярных взаимодействий. В результате, для разрыва этих слабых связей требуется больше энергии, что приводит к повышению температуры кипения.
Таким образом, структура молекул является главным фактором, определяющим повышение температуры кипения циклоалканов по сравнению с алканами.
Форма циклической молекулы
- Циклоалканы имеют форму замкнутого кольца, в котором каждый атом углерода связан с двумя другими атомами углерода и двумя атомами водорода.
- Эти кольца могут быть разных размеров, начиная от трехчленных колов до более сложных, включающих восемь и более атомов углерода.
- Форма кольца имеет прямое влияние на конформацию молекулы - различные способы, в которых атомы углерода и связи могут быть ориентированы в пространстве.
В циклоалканах наблюдаются два основных типа конформаций: замкнутая постоянная конформация и замкнутая изменяющаяся конформация. В замкнутой постоянной конформации все атомы углерода и связи располагаются в одной плоскости.
Замкнутая изменяющаяся конформация позволяет атомам углерода и связям немного изменять свое положение в пространстве. Они могут вращаться вокруг своих связей, изменяя угол между соседними атомами углерода.
Форма циклической молекулы влияет на степень взаимодействия между молекулами и на межмолекулярные силы, такие как ван-дер-Ваальсовы силы. Чем более прямоориентированная форма молекулы, тем сильнее эти силы, что требует большего количества энергии для разрыва связей и перехода к газообразному состоянию.
В результате форма циклической молекулы в циклоалканах приводит к повышению температуры кипения по сравнению с алканами, где атомы углерода образуют прямую цепь. Это объясняет, почему циклоалканы имеют более высокие температуры кипения и меньшую летучесть, чем их аналоги с прямыми цепями.
Связи между атомами
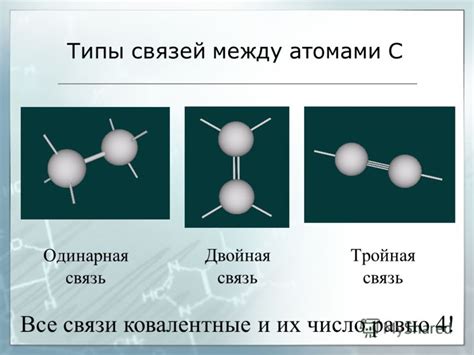
В молекулах алканов, таких как метан (CH4), энергия связей состоит только из сил притяжения между атомами углерода и водорода. Эти связи являются неполярными и обладают довольно слабой силой. Как результат, алканы обычно обладают низкой температурой кипения.
Вместе с тем, в молекулах циклоалканов, таких как циклопентан (C5H10), связи между атомами являются как неполярными, так и полярными. Это происходит из-за более сложной геометрии молекулы, в которой атомы углерода расположены в кольце. Добавление полярных связей приводит к усилению сил притяжения между молекулами циклоалканов. В результате, циклоалканы имеют более высокую температуру кипения по сравнению с алканами.
Кроме того, структура кольца в циклоалканах также создает дополнительные строительные возможности для молекул. Это может приводить к образованию более сложных структур, таких как циклические димеры и многоциклические соединения, которые могут иметь еще более высокую температуру кипения.
Таким образом, связи между атомами в молекулах циклоалканов играют важную роль в определении их температуры кипения. Полярные связи и сложная геометрия кольца циклоалкана приводят к усилению сил притяжения и, следовательно, к повышению температуры кипения по сравнению с алканами.
Взаимодействие молекул
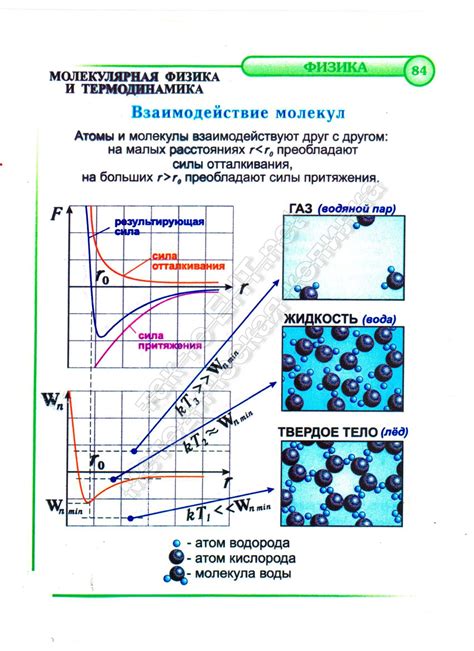
Циклоалканы, в отличие от алканов, имеют кольцевую структуру. В результате этого, молекулы циклоалканов находятся ближе друг к другу и взаимодействуют сильнее.
Молекулы циклоалканов обладают высокой скоростью движения, которая обусловлена их более сложной структурой. Благодаря этому, молекулы циклоалканов часто совершают более энергичные колебания и вращения, что приводит к более интенсивному взаимодействию между ними.
Взаимодействие между молекулами циклоалканов осуществляется силами притяжения, такими как дисперсионные силы Ван-дер-Ваальса, дипольные силы и ковалентные связи.
Дисперсионные силы Ван-дер-Ваальса возникают из-за временного неравномерного распределения электронов в молекулах циклоалканов. Такие временные неравномерности могут создать моментарный диполь, который притягивает другие молекулы циклоалканов.
Дипольные силы возникают из-за наличия постоянного диполя в молекуле циклоалкана. Этот постоянный диполь притягивает другие молекулы с противоположным зарядом, что также способствует более сильному взаимодействию.
Ковалентные связи между молекулами циклоалканов являются более прочными и энергетически выгодными, чем у алканов. Это обеспечивает большую стабильность структуры циклоалканов и повышает их температуру кипения.
Таким образом, взаимодействие молекул циклоалканов является более интенсивным и прочным, что приводит к повышению их температуры кипения по сравнению с алканами.



