Пероксид водорода, также известный как водородный пероксид, является химическим соединением, состоящим из двух атомов водорода и двух атомов кислорода. Несмотря на то что атомы водорода и кислорода образуют связь, в которой электроны распределены неравномерно, степень окисления кислорода в пероксиде водорода всегда равна 1. В этой статье мы рассмотрим причины такого распределения электронов.
Вода, как известно, состоит из одного атома кислорода и двух атомов водорода. Вода является нейтральным соединением, поскольку электроны в этом молекуле равномерно распределены между атомами кислорода и водорода. Но что происходит, когда водородные атомы переносятся в другую молекулу и образуют пероксид водорода?
Электроны в пероксиде водорода, представленные двумя кислородными атомами, распределяются таким образом, что каждый атом кислорода получает один электрон от пары водородных атомов. В результате, кислород имеет степень окисления равную 1, так как каждый атом кислорода имеет один электрон больше, чем в нейтральной молекуле воды.
Простое объяснение

Это связано с тем, что кислород имеет обычно степень окисления -2, но в пероксиде он имеет степень окисления -1. Это происходит из-за наличия двух кислородных атомов в каждой молекуле H2O2. Один из атомов кислорода "подтверждает" положительный заряд водорода, а другой атом кислорода имеет степень окисления -1.
Таким образом, степень окисления кислорода в пероксиде водорода равна 1.
Концепция окисления и восстановления
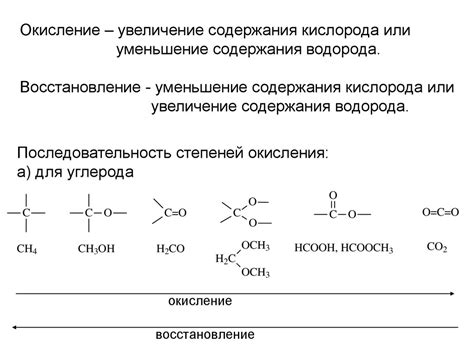
В процессе окисления атом или группа атомов теряют электроны и повышают свою степень окисления. Восстановление, в свою очередь, происходит при приобретении электронов, что приводит к уменьшению степени окисления.
Степень окисления, также известная как окислительное число, определяет количество электронов, которые атом или группа атомов перенесли при окислении или восстановлении. Она может быть положительной, отрицательной или нулевой.
В пероксиде водорода (H2O2) каждый атом кислорода имеет степень окисления, равную -1. Окислительное число кислорода указывает на его склонность к получению электронов, что демонстрирует его классическое "окислительное" поведение. В пероксиде водорода оба атома кислорода изначально имеют степень окисления -1, что суммируется в общую степень окисления вещества, равную -2.
В таком случае, чтобы пероксиду водорода иметь нейтральное заряд состоящий из двух атомов кислорода, атом водорода должен иметь степень окисления +1. Общая сумма степеней окисления в молекуле равна нулю, поскольку пероксид водорода является нейтральным соединением.
Структура пероксида водорода
Пероксид водорода (H2O2) представляет собой простую химическую соединение, состоящее из атомов водорода и кислорода. Его структура имеет особенности, определяющие его свойства.
В пероксиде водорода два атома водорода соединены с атомами кислорода.
Структурная формула H2O2:
H H | | H - O - O - H | | H H
Основная черта, определяющая структуру пероксида водорода, - наличие двух атомов кислорода, связанных друг с другом одной ковалентной связью.
В пероксиде водорода степень окисления кислорода равна 1, так как атом кислорода делит свои электроны с двумя атомами водорода.
Кислород в пероксиде водорода
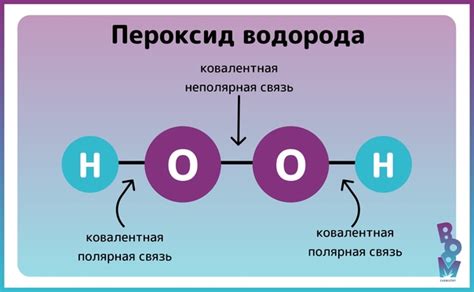
В молекуле пероксида водорода кислород имеет степень окисления, равную 1. Это означает, что каждый атом кислорода делит два электрона с атомами водорода, образуя две ковалентные связи H-O.
Разделение электронов между кислородом и водородом происходит из-за сильной электроотрицательности кислорода. Электроотрицательность - это склонность атома притягивать электроны. Кислород имеет более высокую электроотрицательность по сравнению с водородом, поэтому оно притягивает электроны более сильно.
Этот электронный перенос создает неравенство в распределении электронов в молекуле. В результате одна сторона молекулы имеет более отрицательный заряд, тогда как другая сторона - более положительный заряд. Это делает пероксид водорода положительно поляризованным молекулой.
Процесс окисления кислорода в пероксиде водорода

При окислении кислорода в пероксиде водорода происходит изменение его степени окисления. Кислород имеет стабильное значение степени окисления -2 в большинстве соединений (например, воде H2O). Однако в пероксиде водорода каждый из атомов кислорода имеет степень окисления 1.
Это связано с тем, что каждый атом кислорода связан с другим атомом кислорода с помощью одной избыточной связи, что приводит к разделению электронов между этими атомами. Каждый атом кислорода в пероксиде водорода имеет около себя два атомных ядра водорода, но электроны не могут быть полностью переданы от одного атома к другому из-за общей связи между атомами кислорода.
Это приводит к появлению неравномерного распределения электронной плотности между атомами кислорода, в результате чего каждый атом кислорода приобретает небольшую положительную степень окисления +1, а каждый атом водорода -1.
Таким образом, степень окисления кислорода в пероксиде водорода равна 1, что делает его мощным окислителем в химических реакциях.
Свойства пероксида водорода
Пероксид водорода имеет много интересных свойств и находит широкое применение в разных областях:
| Свойство | Описание |
|---|---|
| Силное окислительное действие | Пероксид водорода обладает сильными окислительными свойствами и может взаимодействовать с различными веществами, особенно с органическими соединениями, вызывая их окисление. |
| Антисептическое действие | Благодаря своей способности уничтожать микроорганизмы, пероксид водорода широко используется в медицине и гигиене как антисептик для обработки ран и поверхностей. |
| Отбеливающее действие | Пероксид водорода используется в бытовых и промышленных целях для отбеливания различных материалов, включая ткани и волосы. |
| Огнестойкость | Пероксид водорода является не горючим веществом, но может усилить горение других материалов, таких как спирт, бензин и др. |
| Антиоксидантное действие | Пероксид водорода способен защищать организм от свободных радикалов и окислительного стресса, благодаря своим антиоксидантным свойствам. |
Эти свойства пероксида водорода вызывают широкий интерес в науке, медицине, бытовых и промышленных сферах, и делают его одним из наиболее используемых химических соединений в мире.
Сила окислителя
Степень окисления кислорода в пероксиде водорода равна 1, так как у каждого атома кислорода есть валентный электрон на нивеле энергии. Пероксид водорода может отдавать один из этих валентных электронов, что приводит к образованию двух ионов водорода (H+). Таким образом, один атом кислорода в пероксиде водорода приобретает степень окисления -1, в то время как другой атом кислорода остается неизменным со степенью окисления 0.
Данная способность пероксида водорода отдавать кислород является основной причиной его широкого использования в промышленности и медицине. Он используется как мощный окислитель для удаления пятен и отбеливания, а также в качестве антисептика и дезинфицирующего средства.
| Вещество | Степень окисления кислорода |
|---|---|
| Пероксид водорода (H2O2) | 1 |
| Вода (H2O) | -2 |
| Кислород (O2) | 0 |
Сравнение степени окисления кислорода
Степень окисления кислорода (число, отражающее сумму всех электронов, которые он получал или отдавал в химической реакции) может различаться в разных соединениях. Рассмотрим сравнение степени окисления кислорода в пероксиде водорода и в других соединениях.
- Пероксид водорода (H2O2): Степень окисления кислорода в пероксиде водорода равна 1. Это связано с тем, что каждый атом кислорода в пероксиде водорода имеет заряд -1.
- Вода (H2O): Вода не является окислителем, поэтому степень окисления кислорода в ней равна 0. Кислород в воде имеет заряд -2, но он не меняется в химических реакциях.
- Озон (O3): Степень окисления кислорода в озоне также равна 0. Кислородные атомы в озоне имеют разный заряд -1 и 0, но их суммарный заряд равен 0.
- Кислород (O2): В молекуле кислорода степень окисления кислорода также равна 0. Оба атома кислорода в молекуле имеют заряд 0.
- Карбонат и сульфат: В соединениях, таких как карбонаты (CO32-) и сульфаты (SO42-), степень окисления кислорода равна -2. В данных ионах каждый атом кислорода имеет заряд -2.
Таким образом, степень окисления кислорода может быть различной в разных соединениях, и в случае пероксида водорода она равна 1.
Продукты окисления пероксида водорода
Главным продуктом окисления пероксида водорода является вода (H2O). В результате реакции, один атом кислорода из пероксида водорода переходит в молекулу воды. При этом степень окисления кислорода в пероксиде водорода уменьшается с 1 до 0.
Если окисление происходит в присутствии катализаторов, то могут образовываться и другие продукты, такие как кислород (O2) или пероксины (R-O-O-R), где R - органический радикал. Образование этих продуктов зависит от условий окисления и химических свойств катализатора.
Окисление пероксида водорода может происходить в различных химических и биологических процессах. Например, в организмах многих живых существ пероксид водорода окисляется водным раствором фермента каталазы, что позволяет контролировать уровень пероксида водорода и предотвращать его негативные эффекты.
Таким образом, продукты окисления пероксида водорода зависят от условий окисления и присутствия катализаторов. Главным продуктом является вода, однако при наличии катализаторов могут образовываться также кислород и пероксины.
Влияние степени окисления на свойства пероксида водорода
Степень окисления кислорода в пероксиде водорода, равная 1, играет важную роль в его свойствах и химических реакциях. Изменение этой степени окисления может привести к значительным изменениям в свойствах пероксида водорода.
Одним из основных свойств пероксида водорода является его окислительная активность. Именно степень окисления кислорода определяет его способность окислять другие вещества. При степени окисления, равной 1, пероксид водорода обладает сильной окислительной активностью.
Наличие кислорода с установленной степенью окисления в пероксиде водорода также определяет его возможность быть донором кислорода. Это делает его полезным в процессах, требующих постоянной доступности кислорода, например, в дыхательной терапии или в биотехнологических процессах.
Степень окисления кислорода также оказывает влияние на стабильность пероксида водорода. Пероксид водорода с более высокой степенью окисления (например, 2) будет менее стабилен и склонен к распаду, освобождая кислород. В то же время, пероксид водорода с низкой степенью окисления (менее 1) может быть менее активным и менее эффективным в реакциях окисления и окислительных процессах.
Таким образом, степень окисления кислорода в пероксиде водорода играет важную роль в его свойствах и определяет его окислительную активность, стабильность и способность быть донором кислорода. Поддержание оптимальной степени окисления кислорода в пероксиде водорода является ключевым для его эффективного использования в различных областях, включая медицинскую, промышленную и научную сферы.



