Когда мы говорим о белках, мы обычно представляем сложные трехмерные структуры. Однако, перед тем как они принимают свою сложную форму, они существуют в виде простой, но удивительно стабильной структуры - первичной структуры. Первичная структура белка - это последовательность аминокислот, из которых они состоят.
Почему первичная структура белка обладает высокой устойчивостью? Ответ кроется в химической природе связей, которые образуют последовательность аминокислот. Главными элементами первичной структуры белка являются пептидные связи. Они образуются между аминокислотами путем реакции конденсации, при которой молекула воды выделяется.
Ссылочная пептидная связь является основой для формирования первичной структуры белка. Она образуется между аминогруппой одной аминокислоты и карбонильной группой другой аминокислоты. Эта связь обладает высокой стабильностью, так как она хорошо сопротивляется гидролизу и другим химическим воздействиям.
Что делает первичную структуру белка столь устойчивой?
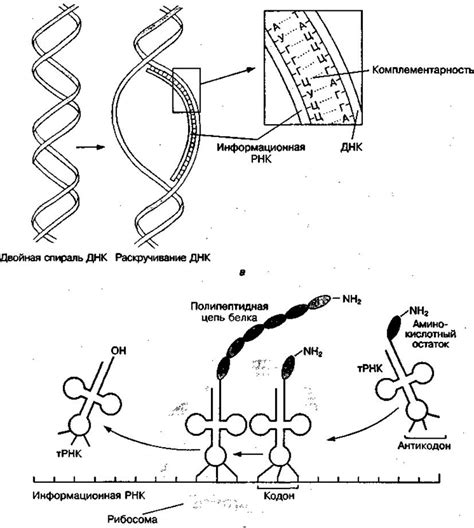
Причина устойчивости первичной структуры белка заключается в ее особой последовательности аминокислот. Каждая аминокислота имеет уникальные химические свойства, такие как заряд, гидрофобность или гидрофильность. Комбинация этих свойств в последовательности аминокислот определяет форму и структуру белка, что в свою очередь определяет его функцию.
Аминокислоты в первичной структуре белка связываются между собой пептидными связями, образуя длинную полимерную цепочку. Пептидные связи являются ковалентными связями, которые обладают высокой энергией и прочностью, делая первичную структуру устойчивой.
Кроме того, основные связи между аминокислотами, такие как водородные связи, взаимодействия гидрофобных остатков и сульфидные мосты, играют важную роль в формировании и стабилизации структуры белка. Все эти связи обеспечивают устойчивость первичной структуры и позволяют белку сохранять свою форму и функцию.
Другим фактором, обеспечивающим устойчивость первичной структуры белка, является эволюционная консервативность. Многие белки имеют свою уникальную последовательность аминокислот, которая пришла к ним в результате эволюции и подбора. Эта уникальная последовательность является оптимальной для конкретной функции белка, и как следствие, ее сохранение обеспечивает устойчивость первичной структуры.
В итоге, комбинация уникальной последовательности аминокислот, прочных пептидных связей, взаимодействий между аминокислотами и эволюционной консервативности делает первичную структуру белка столь устойчивой. Эта устойчивость обеспечивает стабильность и функциональность белка, что играет важную роль в его работе в организме.
Белковая цепочка несет важные функции

Первичная структура белка представляет собой уникальную последовательность аминокислотных остатков, которые соединены между собой пептидными связями. Эта последовательность определяет функциональные свойства белка и выполняет ряд важных функций.
Один из главных аспектов первичной структуры белка – ее высокая устойчивость. Данная устойчивость обеспечивается специфическими связями, существующими между аминокислотными остатками. Пептидные связи, которые образуются между карбоксильной группой одной аминокислоты и аминогруппой другой, являются одними из самых прочных в химии.
Благодаря своей устойчивости, первичная структура белка остается практически неизменной при воздействии различных факторов, таких как изменение pH, температуры или наличие различных реагентов. Это позволяет белкам функционировать в самых разных условиях.
Белковая цепочка выполняет множество важных функций в организме:
- Белки участвуют в каталитических реакциях, ускоряя химические процессы в клетках.
- Они являются структурными элементами организма, образуя костяк из которого построены клетки, ткани и органы.
- Белки участвуют в передаче сигналов между клетками, обеспечивая связь и взаимодействие между ними.
- Они играют важную роль в иммунной системе, защищая организм от вредных воздействий и инфекций.
Изучение первичной структуры белка является основой для понимания его функций и связанных с ним процессов в организме. Благодаря этому знанию, ученые могут разрабатывать новые методы лечения, диагностики и прогнозирования болезней, связанных с нарушениями в работе белковых структур.
Универсальность аминокислот в первичной структуре
Каждая аминокислота имеет свою характеристику боковой цепи, определяющую ее уникальные свойства. Некоторые аминокислоты обладают положительным или отрицательным зарядом, что позволяет им взаимодействовать с другими заряженными аминокислотами и стабилизировать структуру белка. Другие аминокислоты могут образовывать водородные связи, основные связи, сульфидные мосты и другие типы химических связей, которые способствуют укреплению первичной структуры.
Универсальность аминокислот также проявляется в их разнообразии и возможности замещения. В некоторых случаях незначительные изменения в первичной структуре белка могут обеспечить адаптацию к новым условиям или функциям. Например, замена одной аминокислоты на аналогичную с подобным химическим свойством может не привести к серьезным изменениям в структуре и функции белка.
Благодаря универсальности аминокислот, первичная структура белка остается стабильной и сохраняет свою функциональность при изменяющихся условиях. Это позволяет белкам выполнять различные биологические функции и быть устойчивыми к внешним воздействиям.
Интеракции между аминокислотами и структурой
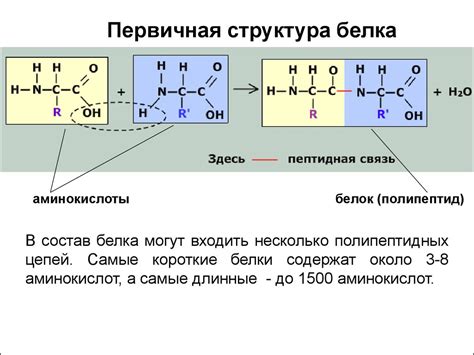
Первичная структура белка определяется последовательностью аминокислот, которые связываются друг с другом, образуя серию химических связей. Взаимодействие между аминокислотами играет ключевую роль в формировании трехмерной структуры белка и обуславливает его высокую устойчивость.
Аминокислоты, которые составляют белок, могут быть различными по своим физико-химическим свойствам. Некоторые аминокислоты могут иметь положительный или отрицательный заряд, другие - гидрофильные или гидрофобные свойства. Эти разнообразные свойства аминокислот обеспечивают разнообразие взаимодействий между ними.
Одним из важных типов взаимодействий является водородная связь. Данное взаимодействие возникает между атомами водорода и атомами кислорода или азота. Оно обеспечивает стабильность трехмерной структуры белка и способствует его устойчивости.
Другим типом взаимодействий являются гидрофобные эффекты. Гидрофобные аминокислоты, не растворимые в воде, стремятся быть сосредоточенными внутренней части белка, создавая гидрофобный "ядро". Это "ядро" играет важную роль в стабилизации структуры белка и предотвращении его разрушения.
Также, существуют электростатические взаимодействия между заряженными аминокислотами. Положительный и отрицательный заряды привлекают друг друга, что способствует стабилизации белковой структуры.
Интеракции между аминокислотами и структурой белка обеспечивают его высокую устойчивость и функционирование. Изучение этих взаимодействий позволяет глубже понять природу белков и разработать новые методы модификации и проектирования структуры белков с целью создания более стабильных и функционально активных белковых продуктов.
Стабильность связей пептидных цепей
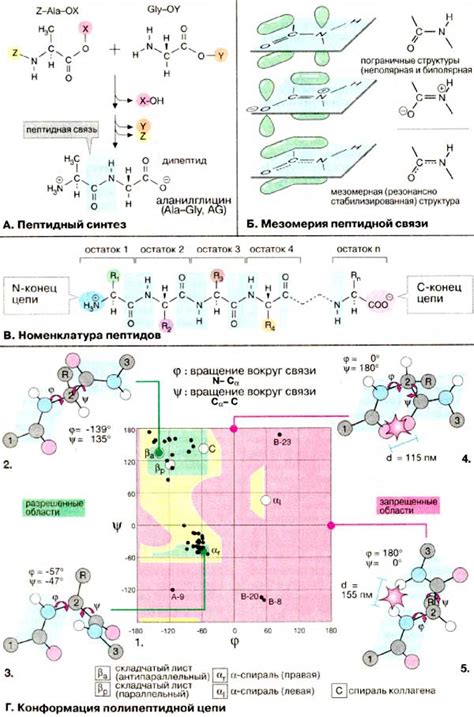
Во-первых, основную роль в устойчивости связей пептидных цепей играет их химическое строение. Пептидная связь состоит из атомов кислорода и азота, которые образуют двойную связь. Эта связь является довольно прочной и обладает большой энергией. Кроме того, пептидные связи окружены боковыми цепями аминокислот, которые также вносят свой вклад в стабильность структуры.
Во-вторых, стабильность связей пептидных цепей обусловлена зарядом аминокислот. Часть аминокислот имеет положительный или отрицательный заряд, что позволяет им формировать электростатическое взаимодействие с другими заряженными аминокислотами. Это способствует более прочной связи между аминокислотами и повышает стабильность структуры белка.
В-третьих, стабильность связей пептидных цепей обеспечивается водородными связями. Водородные связи возникают между атомами водорода и кислородом или азотом в пептидной цепи. Они являются слабыми, но множественные водородные связи между аминокислотами значительно повышают устойчивость структуры белка.
В-четвертых, стабильность структуры белка также зависит от правильного взаимодействия гидрофобных и гидрофильных аминокислот. Гидрофобные аминокислоты стремятся скрыться от воды и образовывают гидрофобные ядрa белка. Гидрофильные аминокислоты, напротив, вступают во взаимодействие с водой. Это взаимодействие обеспечивает стабильность структуры белка.
Таким образом, стабильность связей пептидных цепей определяется не только химическим строением связи, но и зарядом аминокислот, водородными связями и правильным взаимодействием гидрофобных и гидрофильных аминокислот. Эти факторы способствуют высокой устойчивости первичной структуры белка.
Устойчивость первичной структуры к изменениям внешней среды

Первичная структура белков обладает высокой устойчивостью к изменениям внешней среды благодаря своей специфичности и уникальным свойствам. Белки состоят из последовательности аминокислот, которая определяется генетическим кодом в ДНК. Эта последовательность определяет конкретную структуру белка и его функционирование.
Однако, изменения внешней среды, такие как изменение pH, температуры или наличие различных химических веществ, могут влиять на первичную структуру белка. Некоторые изменения могут привести к нарушению связей между аминокислотами и разрушению их последовательности, что может повлиять на функционирование белка.
Тем не менее, устойчивость первичной структуры белка обеспечивается рядом факторов. Во-первых, аминокислоты, из которых состоят белки, обладают химической стабильностью и могут выдерживать изменения внешней среды. Кроме того, белки имеют специфическую 3D-структуру, которая существенно влияет на их устойчивость. Эта структура формируется благодаря взаимодействию аминокислотных остатков между собой, образуя стабильные связи.
Другим важным фактором является наличие физиологических буферных систем, которые помогают поддерживать стабильность pH и химического состава внутри клетки или организма. Это позволяет сохранять оптимальные условия для функционирования белков и поддерживать их первичную структуру.
Таким образом, устойчивость первичной структуры белка обеспечивается совокупностью факторов, включая химическую стабильность аминокислот, 3D-структуру, взаимодействие аминокислотных остатков и наличие буферных систем. Это позволяет белкам эффективно выполнять свои функции даже при изменениях внешней среды.
Потенциал для создания трехмерной структуры

Первичная структура белка, представляющая собой линейный порядок аминокислот, обладает потенциалом для образования сложной трехмерной конформации. Это связано с тем, что каждая аминокислота в составе белка имеет специфические химические свойства и взаимодействия.
Аминокислоты могут вступать в различные типы связей, такие как ковалентные, ионные, водородные и вани-дер-ваальсовы взаимодействия. Эти связи определяют взаимное расположение аминокислот и формируют стабильные элементы вторичной структуры - α-спирали, β-листы и другие.
Межатомные взаимодействия и гидрофобные эффекты способствуют формированию устойчивых трехмерных структур, таких как протеиновые домены, подразделы и весь белок в целом. Эти структуры могут быть динамическими и изменяться под влиянием внешних факторов, но их первоначальное формирование обычно происходит с большой эффективностью.
Благодаря сложной трехмерной структуре белки могут выполнять свои функции, такие как связывание с другими молекулами, катализ химических реакций и передача сигналов в клетке. Высокая устойчивость первичной структуры белка и ее потенциал для формирования трехмерной конформации являются важными особенностями, определяющими белковую функцию и их роль в клеточных процессах.
Эволюционное свойство первичной структуры

Одним из основных механизмов эволюционного изменения первичной структуры белка является мутация. Мутации возникают в генетическом материале организмов и могут приводить к изменению последовательности аминокислот в белке. Именно благодаря мутациям появляются новые варианты белковых структур, которые могут быть полезными для выживания и размножения организма.
Процесс эволюции выбирает наиболее выгодные изменения первичной структуры белка и сохраняет их в последующих поколениях. Таким образом, с течением времени, первичная структура белка может изменяться и совершенствоваться. Это позволяет организмам адаптироваться к изменяющимся условиям окружающей среды и повышать свою конкурентоспособность.
Высокая устойчивость первичной структуры белка связана с ее важной ролью в функционировании белка. Правильная последовательность аминокислот обеспечивает правильное сворачивание белка, его взаимодействие с другими молекулами и выполнение специфических функций. Любое изменение в первичной структуре может привести к снижению или потере функциональности белка, что может быть неблагоприятным для организма в конкретных условиях.
Процессы сборки и распада белковой цепочки
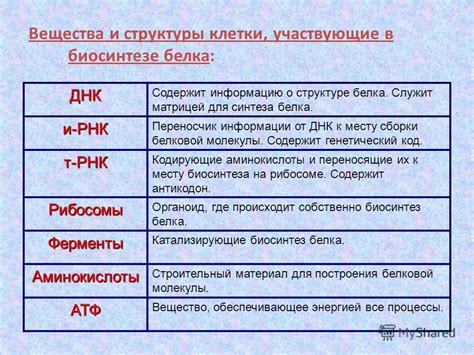
Первичная структура белка, представляющая собой последовательность аминокислот, формируется на уровне генетической информации в ДНК. Однако, перед тем как белок примет свою функциональную форму, происходят процессы сборки и распада белковой цепочки.
Процесс сборки, или синтез белков, осуществляется рибосомами - специальными структурами внутри клетки. Рибосомы считывают информацию из молекулы мРНК, которая является промежуточным этапом переноса генетической информации из ДНК в форму белка. По мере считывания информации, рибосомы соединяют аминокислоты в определенной последовательности, построенной по заданной генетической информации. Это позволяет формировать первичную структуру белка.
После сборки цепочки, происходит процесс распада белковой цепочки. Этот процесс может быть вызван разными факторами, такими как изменение pH или температуры окружающей среды, наличие определенных ферментов или детергентов. Распад цепочки может привести к потере вторичной и третичной структуры белка, что в свою очередь может привести к потере его функциональности.
Несмотря на то что первичная структура белка обладает высокой устойчивостью, процессы сборки и распада цепочки могут происходить в организме в течение его жизненного цикла. Эти процессы могут быть контролируемые или неконтролируемые и могут играть важную роль в регуляции биологических процессов и адаптации к переменным условиям окружающей среды.
Значение первичной структуры для биологических функций

- Определение терциарной структуры: Первичная структура определяет последующую сложную трехмерную конформацию белка. Аминокислотная последовательность определяет, какие связи, какие водородные связи и гидрофобные взаимодействия возникают между различными участками белковой цепи. Это определение пространственной структуры белка влияет на его функциональность и способность взаимодействовать с другими молекулами в клетке.
- Устойчивость: Первичная структура белка обладает высокой устойчивостью благодаря специфическим последовательностям аминокислот. Взаимодействия между аминокислотами, такими как водородные связи и гидрофобные взаимодействия, обеспечивают прочную связь между различными участками белковой цепи. Это позволяет белковой молекуле сохранять свою трехмерную структуру даже в условиях высокой температуры, pH-изменений или наличия разных физических и химических агентов.
- Биологическая функция: Первичная структура белка определяет его специфичность и функциональность. Различные аминокислоты, составляющие белковую цепь, играют роль взаимодействия с другими молекулами в клетке, как реактивными субстратами, ферментами, рецепторами или транспортными белками. Первичная структура определяет специфические свойства белка, его активность и роль в клеточных процессах.
Изучение первичной структуры белка является важным шагом для понимания его функций и механизмов в клетке. Понимание значимости первичной структуры белка помогает улучшить наши знания в области биологии и медицины, а также может привести к разработке новых терапевтических методов и лекарств.



