В физических и химических процессах существует такое понятие, как равновесие, когда скорость протекания прямой и обратной реакции становится одинаковой. Однако, не все процессы обладают данной свойством и многие из них являются неравновесными. Такие процессы невозможно обратить, и это вызывает интерес исследователей. В этой статье мы рассмотрим причины и объяснение этого феномена.
Основной причиной, по которой неравновесные процессы не обратимы, является нарушение принципов термодинамики. В равновесной системе энергия распределена равномерно между частицами, и система достигает стабильного состояния. Однако, в неравновесных системах энергия распределяется неравномерно, и в них сохраняется направление протекания процесса.
Другая причина, почему неравновесные процессы не обратимы, связана с изменением концентрации реагентов и продуктов. В равновесной системе концентрации остаются постоянными и не меняются со временем. В неравновесных процессах происходит изменение концентрации, что приводит к невозможности вернуться к исходным условиям и начать процесс в обратном направлении.
Возникновение неравновесных процессов

Неравновесные процессы возникают, когда система находится в состоянии, отличном от равновесия, и не стремится достичь равновесия. Причины возникновения неравновесных процессов могут быть различными.
Одной из причин может быть воздействие внешних факторов на систему. Например, изменение температуры, давления или концентрации реагентов может нарушить равновесие и привести к возникновению неравновесного процесса.
Другой причиной может быть наличие активных компонентов или катализаторов в системе. Взаимодействие этих компонентов может привести к появлению неравновесных процессов и непрерывному протеканию химических реакций.
Кроме того, изменение условий окружающей среды, таких как предельные значения температуры или давления, может вызвать возникновение неравновесных процессов.
Результатом неравновесных процессов часто является образование новых соединений, изменение свойств вещества или сдвиг в сторону равновесия. Более подробное изучение неравновесных процессов не только помогает понять фундаментальные принципы химии, но и находит практическое применение в различных отраслях промышленности и науке.
| Причины возникновения неравновесных процессов: |
|---|
| Изменение внешних факторов, таких как температура, давление или концентрация |
| Присутствие активных компонентов или катализаторов в системе |
| Изменение условий окружающей среды |
Причины неравновесных процессов

Неравновесные процессы возникают в системах, где не достигнута установившаяся равновесия между различными состояниями. Это может быть вызвано несколькими причинами:
1. Внешние воздействия: изменения внешних условий, такие как изменение температуры, давления или концентрации реагентов, могут нарушить равновесие и привести к неравновесному процессу. Например, повышение температуры может активировать реакцию, которая обычно происходит медленно при низких температурах.
2. Кинетические факторы: некоторые реакции могут быть кинетически заторможенными, что значит, что они происходят медленно в отсутствие внешних воздействий. Даже если система находится в состоянии равновесия, малые изменения условий могут нарушить это равновесие и запустить неравновесный процесс.
3. Неравенство концентраций: неравновесные процессы могут возникать в системах, где различные компоненты имеют разную концентрацию или активность. Разница в концентрациях может быть вызвана смешиванием реагентов, разделением фаз, диффузией или дисперсией. Неравновесные процессы ищут установившееся равновесие, чтобы минимизировать эту разницу в концентрациях.
4. Уравновешивание энергии: некоторые процессы требуют энергии для достижения стабильного состояния равновесия. Если не хватает энергии, процесс может оставаться неравновесным. Например, определенные химические реакции могут потребовать внешнего источника энергии, такого как нагревательный элемент или фотонная активация.
Понимание причин неравновесных процессов важно для разработки стратегий управления и контроля неравновесных систем в различных науках и технологиях, от химии и биологии до инженерии и физики.
Понятие обратимости процессов

Обратимые процессы характеризуются тем, что между входными и выходными состояниями можно установить прямую и обратную связь. В противоположность этому, неравновесные процессы не обладают такой связью и не могут протекать в обратном направлении без вмешательства внешней системы.
Основной причиной отсутствия обратимости в неравновесных процессах является наличие внешних факторов, которые препятствуют обратному движению системы в исходное состояние. Это может быть связано с необратимыми химическими реакциями, потерей энергии в виде тепла или затратами энергии на перемещение вещества против градиента концентрации.
Применение понятия обратимости процессов позволяет изучать и предсказывать характеристики системы на основе входных данных и условий. Обратимость является фундаментальным свойством процессов и активно используется в различных областях, таких как физика, химия, биология, инженерия и информационные технологии.
| Преимущества обратимых процессов: | Недостатки неравновесных процессов: |
|---|---|
| Возможность установления равновесия | Отсутствие обратной связи |
| Повышение эффективности системы | Потеря энергии и информации |
| Прогнозируемый и контролируемый характер | Неопределенность результатов |
Свойства неравновесных процессов

Неравновесные процессы, в отличие от равновесных процессов, характеризуются рядом специфических свойств, которые важны для понимания их природы и применения. Вот несколько основных свойств неравновесных процессов:
- Неравновесие: Неравновесные процессы отличаются от равновесных тем, что система находится в постоянном движении, сохраняя свою энергию и массу. Неравновесные процессы происходят в системах, где существуют различия в концентрациях, температурах, давлениях или других параметрах.
- Избыточная энергия: В неравновесных процессах система обладает избытком энергии, что может приводить к различным физическим и химическим изменениям. Избыточная энергия может проявляться в виде повышенной активности молекул, изменениях температуры или давления, формировании новых связей и т.д.
- Направленность: В неравновесных процессах наблюдается определенное направление, характеризующееся изменениями параметров системы. Направленность процесса может быть вызвана различными факторами, такими как концентрационные градиенты, термодинамические условия или внешние возмущения.
- Некомпенсируемость: В отличие от равновесных процессов, неравновесные процессы не могут быть полностью компенсированы или возвращены в исходное состояние. Это связано с необратимостью физических или химических изменений, происходящих в системе в процессе неравновесности.
- Мощность процесса: Неравновесные процессы могут быть энергетически интенсивными, то есть требовать значительный вход или выход энергии. Это связано с трансформацией энергии внутри системы или ее передачей от системы к окружающей среде. Мощность процесса может быть использована в различных технологических или промышленных процессах.
Изучение свойств неравновесных процессов позволяет лучше понять их природу и использовать их в различных областях науки и технологии. Неравновесные процессы играют важную роль в химии, физике, биологии и других науках, а также в промышленности и быту.
Изменение энтропии

Когда система находится в состоянии равновесия, ее энтропия достигает максимального значения. В таком состоянии энтропия не может изменяться без внешнего воздействия.
Однако, когда система находится в неравновесном состоянии, ее энтропия может увеличиваться или уменьшаться относительно равновесного значения. Это изменение энтропии связано с увеличением беспорядка в системе.
Процессы, связанные с увеличением энтропии системы, называются процессами увеличения энтропии или процессами диссипации. Такие процессы обычно сопровождаются потерей энергии в виде тепла.
На противоположном полюсе находятся процессы, связанные с уменьшением энтропии системы. Эти процессы требуют внешнего воздействия и обратного потока энергии для восстановления равновесного состояния.
Таким образом, неравновесные процессы не обратимы из-за изменения энтропии системы. Увеличение энтропии ведет к увеличению беспорядка и необратимому характеру процесса.
| Причины необратимости |
|---|
| Распределение энергии |
| Изменение состояния системы |
| Потеря энергии в виде тепла |
| Требует внешнего воздействия |
Эффекты необратимости

В природе существует несколько фундаментальных эффектов, которые приводят к необратимости процессов. Рассмотрим некоторые из них:
Энтропийный эффект: Согласно второму закону термодинамики, энтропия в изолированной системе всегда возрастает или остается постоянной. Это означает, что процессы, связанные с увеличением энтропии, не могут быть обратимыми.
Необратимые химические реакции: Некоторые химические реакции происходят в одном направлении и не могут быть обратимыми без вмешательства внешней силы. Например, процессы окисления или горения сопровождаются выделением энергии и изменением состава вещества, что делает их необратимыми.
Диссипативные структуры: В некоторых системах возникают диссипативные структуры, которые проявляют сложное поведение с характерными временными и пространственными шкалами. Эти структуры устойчивы и не могут быть легко разрушены или развеяны, что делает процессы, связанные с ними, необратимыми.
Временная эволюция системы: Время играет важную роль в необратимости процессов. Под воздействием внешних факторов система может эволюционировать в определенном направлении, и восстановление исходного состояния может быть практически невозможным из-за различных эффектов, таких как диффузия, трение, диссипация и т. д.
Все эти эффекты объединяются вместе и приводят к необратимости процессов. Понимание этих эффектов является важным для многих областей науки, включая физику, химию, биологию и технику.
Примеры неравновесных процессов

В природе существует множество примеров неравновесных процессов, которые не могут обратно вернуться к исходному состоянию. Некоторые из них включают:
- Химические реакции: В химической реакции могут формироваться новые химические связи или разрушаться существующие. Когда реакция достигает равновесия, скорость обратной реакции становится равной скорости прямой реакции. Однако, если системе изменить условия (например, температуру или концентрацию реагентов), процесс может снова стать неравновесным и протекать только в одном направлении.
- Тепловые процессы: Примером неравновесного теплового процесса может служить нагревание или охлаждение воздуха. Когда воздух нагревается, его молекулярная кинетическая энергия увеличивается, а объем расширяется. Однако, если системе изменить условия (например, снизить температуру), процесс может стать неравновесным и тепло будет перемещаться только в одном направлении.
- Электрические процессы: Разряд в батарее является примером неравновесного электрического процесса. Когда батарея разряжается, электроны проходят через цепь и происходит преобразование химической энергии в электрическую. Однако, процесс не может обратно вернуться к исходному состоянию и батарею нужно заряжать, чтобы она снова стала готова к использованию.
Эти примеры показывают, что неравновесные процессы обычно вызваны изменением условий или потерей энергии, и они не могут обратно вернуться к исходному состоянию без внешнего воздействия.
Химические реакции

Однако не все химические реакции являются обратимыми, то есть не все процессы могут происходить в обратную сторону. Существует ряд причин, по которым неравновесные химические реакции не обратимы.
1. Энергия активации: Некоторые химические реакции требуют большого количества энергии для их протекания. Для обратных реакций необходимо предоставить такую же или большую энергию активации. В некоторых случаях это может быть трудно или даже невозможно, что делает обратную реакцию нереализуемой.
2. Образование нестабильных промежуточных соединений: В некоторых случаях, для протекания реакции, образуются нестабильные промежуточные соединения. Эти соединения могут распадаться или превращаться в другие вещества, что предотвращает обратную реакцию.
3. Смещение равновесия: При химических реакциях, достижение равновесного состояния может занять продолжительное время, особенно для реакций, которые сопровождаются образованием газовых продуктов. Когда равновесие достигнуто, для обратной реакции необходимо изменить условия, что может быть сложно или невозможно.
4. Нарушение закона сохранения массы: Обратная реакция может быть препятствована нарушением закона сохранения массы. Например, если во время протекания реакции происходит потеря или приобретение массы, обратная реакция может быть невозможной из-за физических ограничений.
Понимание причин, по которым неравновесные химические реакции не обратимы, помогает ученым и инженерам лучше контролировать и оптимизировать процессы промышленного производства, разрабатывать новые лекарства и материалы, и улучшать понимание множества явлений, происходящих в природе.
Тепловое равновесие
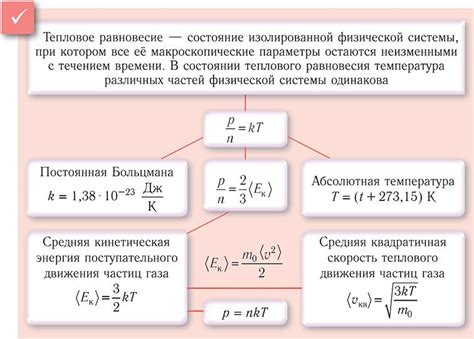
Тепловое равновесие достигается в системе, когда разность температур между ее составляющими частями становится незначительной. Это означает, что нет больше нет нетжеобходимости в передаче тепла для достижения уравновешенного состояния. В результате теплового равновесия система достигает стабильности и долговечности.
Однако, неравновесные процессы не могут достичь теплового равновесия. Они характеризуются постоянными тепловыми потоками, которые не прекращаются и не переходят в покой. Это связано с тем, что в неравновесных процессах происходят различные изменения, такие как изменение концентраций или давлений, которые поддерживают неравновесное состояние.
Таким образом, причиной невозможности обратимости неравновесных процессов является поддержание постоянного теплового потока, который необходим для поддержания неравновесного состояния. В отсутствие этого потока система не может достичь теплового равновесия и вернуться к своему исходному состоянию.
Влияние неравновесных процессов на окружающую среду

Неравновесные процессы имеют значительное влияние на окружающую среду. В отличие от равновесных процессов, которые происходят спонтанно и без потребления энергии, неравновесные процессы требуют энергии для поддержания их нестабильного состояния.
Примером неравновесного процесса, имеющего негативное влияние на окружающую среду, является выбросы промышленных отходов в атмосферу. Когда промышленные предприятия неэффективно используют ресурсы или не применяют современные методы обработки отходов, выбросы загрязняют воздух и ведут к ухудшению качества атмосферы.
Неравновесные процессы также могут приводить к изменению природных экосистем. Например, несбалансированное использование водных ресурсов ведет к высыханию рек и озер, что негативно сказывается на экосистеме и животных, зависящих от этих водных источников.
Кроме того, неконтролируемые неравновесные процессы могут вызывать катастрофические последствия, такие как аварии на ядерных электростанциях или выбросы опасных химических веществ в окружающую среду. Эти события могут привести к серьезным разрушениям окружающей среды и угрожать жизни людей и животных.
Установление равновесия в неравновесных процессах имеет важное значение для устойчивого развития и сохранения окружающей среды. Это требует принятия мер по улучшению эффективности использования ресурсов, снижению выбросов загрязняющих веществ и разработке новых технологий, которые позволят контролировать и минимизировать негативное воздействие неравновесных процессов на окружающую среду.
Экологические последствия

Неравновесные процессы, которые не обратимы, оказывают значительное влияние на окружающую среду и вызывают серьезные экологические последствия.
Одним из наиболее известных примеров таких процессов является изменение климата. Выделение большого количества парниковых газов, таких как диоксид углерода, в атмосферу приводит к увеличению температуры Земли. Это вызывает ряд негативных последствий, таких как таяние ледников и арктического льда, повышение уровня морей и океанов, а также изменение погодных условий и климатических зон.
Кроме того, неравновесные процессы могут приводить к ухудшению качества воздуха и воды, засорению почвы и разрушению экосистем. Процессы, которые не обратимы, такие как загрязнение атмосферы промышленными выбросами, а также вымирание видов живых организмов, оказывают долгосрочное негативное воздействие на биоразнообразие планеты.
Понимание этих экологических последствий неравновесных процессов является важным шагом для разработки и внедрения мер по борьбе с изменением климата и сохранению окружающей среды.
Климатические изменения
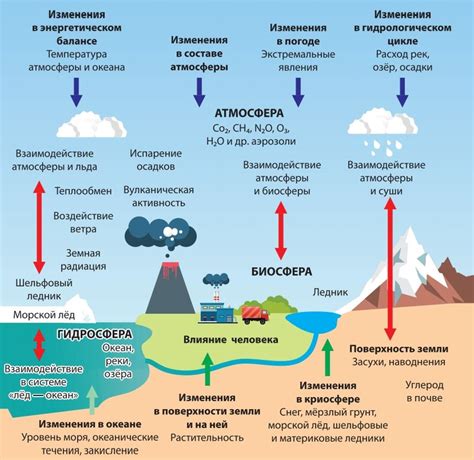
В основе климатических изменений лежат неравновесные процессы, которые необратимы по своей природе. Причины и объяснение этой необратимости включают:
- Увеличение уровня парниковых газов: Рост концентрации парниковых газов в атмосфере, особенно углекислого газа и метана, приводит к усилению парникового эффекта. Эти газы поглощают и перераспределяют тепловое излучение, что приводит к повышению температур на Земле. Увеличение уровня парниковых газов происходит из-за деятельности человека, включая сжигание ископаемого топлива и вырубку леса.
- Обратная связь: В климатической системе существуют различные обратные связи, которые могут усилить или ослабить эффекты климатических изменений. Например, рост температуры может приводить к уселению плавления льдов в Арктике, что, в свою очередь, усиливает глобальное потепление за счет уменьшения отражения солнечной радиации. Эти обратные связи дополняют друг друга и усиливают изменения, делая их необратимыми.
- Длительность процессов: Климатические изменения - это длительные процессы, которые происходят на протяжении многих лет и десятилетий. Это означает, что даже если мы прекратим выбрасывать парниковые газы прямо сейчас, изменения, которые уже произошли, будут продолжаться десятилетиями. Например, повышение уровня морей в результате таяния ледников и таких гигантских ледяных шапок как Гренландия - процесс, который займет много лет и не может быть обращен обратно.
В целом, климатические изменения являются сложной системой взаимосвязанных процессов, которые необратимы по своей природе. Понимание этих причин и объяснение необратимости процессов может помочь нам принимать необходимые меры для смягчения и адаптации к изменениям климата, которые уже происходят и будут продолжаться в будущем.



