Кислоты - это вещества, которые могут отдавать водородные ионы (H+) в растворе. Однако, не все кислоты обладают одинаковой силой. Некоторые из них считаются слабыми, а другие - сильными. В чем же причина этого различия?
Все дело в структуре молекулы кислоты. Если молекула кислоты достаточно легко отделяет водородные ионы, то она считается сильной кислотой. В противном случае, она является слабой кислотой. Кроме того, кислоты обладают различной степенью ионизации. Если кислота полностью ионизируется в растворе, то она считается сильной. Если же только небольшая часть молекул кислоты разлагается на ионы, то она является слабой кислотой.
Важную роль также играют концентрация и температура раствора. Чем выше концентрация кислоты, тем больше ионов она отдаст в раствор и, следовательно, станет сильнее. Температура также может влиять на силу кислоты, поскольку некоторые реакции становятся более активными при повышении температуры, что приводит к большей ионизации кислоты.
Выбор кислотного раствора в зависимости от силы кислоты

Сила кислоты имеет важное значение при выборе кислотного раствора. Она определяет, насколько легко кислота отдает свои протоны в растворе. Сильные кислоты обладают высокой способностью отдавать протоны, в то время как слабые кислоты могут отдавать протоны с трудом.
Когда выбирается кислотный раствор для определенного процесса или эксперимента, учитывается сила кислоты. Для некоторых приложений лучше подходят сильные кислоты, так как они обеспечивают быструю и эффективную реакцию. Например, при очищении или дезинфекции поверхностей, широко используются сильные кислоты, такие как серная или соляная кислота.
С другой стороны, слабые кислоты используются там, где требуется мягкое воздействие или контроль pH. Например, в биологических и медицинских исследованиях или процессах, предпочтительно использовать слабые кислоты, чтобы избежать повреждения тканей или клеток.
Выбор кислотного раствора также может зависеть от его стойкости, безопасности или доступности. Сильные кислоты, такие как щелочи или азотная кислота, могут быть опасными или труднодоступными, поэтому для некоторых приложений могут быть предпочтительны слабые кислоты, вроде уксусной кислоты.
При выборе кислотного раствора в зависимости от силы кислоты следует учитывать требования и особенности конкретного процесса или эксперимента. На основе этого можно выбрать оптимальный раствор с нужными характеристиками силы кислоты.
Сильные кислоты: основная информация

Процесс ионизации кислоты заключается в ее разделении на ионы в воде. Сильные кислоты полностью ионизируются, что означает, что все молекулы кислоты превращаются в ионы водорода (H+) и соответствующие анионы. Это является причиной их сильной кислотности.
Из-за своей высокой степени ионизации, сильные кислоты обладают рядом характеристических свойств:
- Они образуют сильные электролиты, то есть могут проводить электрический ток в водном растворе.
- Концентрированные растворы сильных кислот могут обладать высокой степенью коррозии и опасны для обработки и хранения.
- Сильные кислоты обладают характерным кислым вкусом и запахом.
Кроме того, сильные кислоты часто используются в различных областях химии и промышленности. Они могут быть использованы для регулирования pH в различных процессах, включая производство удобрений, пищевой и текстильной промышленности, очистку воды и многое другое.
Сильные кислоты имеют важное значение в химической науке и учебной программе. Изучение их свойств и реакций помогает понять основы химических процессов и их применение в различных областях жизни.
Слабые кислоты и их особенности
Основными особенностями слабых кислот являются:
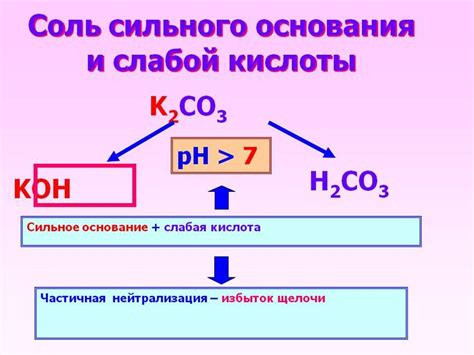
- Неполная диссоциация. В растворе слабая кислота образует не полностью ионы водорода (H+), а лишь небольшую долю ионов, образуя равновесие между ионизированными и невещественными частицами.
- Обратимость. Равновесие между ионизированными и невещественными формами слабой кислоты может быть сдвинуто влево или вправо в зависимости от условий окружающей среды, таких как концентрация веществ, температура или наличие реакционных компонентов.
- Низкая электропроводность. Из-за неполной диссоциации слабые кислоты имеют низкую электропроводность в растворе по сравнению со сильными кислотами, которые полностью диссоциируют и образуют большое количество ионов.
- Функции буферов. Слабые кислоты играют важную роль в поддержании постоянства рН в организмах живых существ и в природных системах. Они могут служить компонентами буферных систем, которые помогают поддерживать стабильность кислотно-щелочного баланса внутри клеток и на уровне организма.
Примерами слабых кислот могут служить органические соединения, такие как уксусная кислота (CH3COOH), молочная кислота (C3H6O3) или соляная кислота (H2CO3). Каждая из этих кислот имеет свою специфическую степень ионизации и характеристики равновесия.
Что влияет на степень кислотности раствора?

Степень кислотности раствора зависит от нескольких факторов:
- Концентрация кислоты: Чем выше концентрация кислоты в растворе, тем сильнее он будет кислотным. Например, разбавленная серная кислота будет слабой кислотой, а концентрированная серная кислота будет сильной кислотой.
- Структура кислотного молекулы: Некоторые кислоты имеют молекулярную структуру, которая способствует легкому отдаче протона, делая такие кислоты сильными кислотами. Например, хлороводородная кислота (HCl) имеет простую структуру и является сильной кислотой.
- Свойства растворителя: Вода обладает свойствами, которые могут усилить кислотность раствора. Например, вода может образовывать водородные связи с кислотными молекулами, что способствует их диссоциации.
- Температура: Температура также может влиять на степень кислотности раствора. Обычно повышение температуры увеличивает скорость реакции кислоты, что может привести к большей степени диссоциации и, следовательно, к большей степени кислотности.
Важно отметить, что степень кислотности раствора измеряется по шкале pH, где кислотные растворы имеют значения pH меньше 7, а более кислые растворы имеют более низкие значения pH.
Практическое применение сильных и слабых кислот

Сильные кислоты
Сильные кислоты обладают высокой степенью диссоциации в водном растворе и являются хорошими протонными донорами. Они широко используются в следующих областях:
- Промышленная химия: сильные кислоты, такие как серная и хлористоводородная кислоты, используются в процессах производства различных химических соединений.
- Лабораторные исследования: сильные кислоты широко применяются в лабораториях для регулирования pH растворов и проведения различных химических реакций.
- Очистка поверхностей: в промышленности сильные кислоты применяются для удаления загрязнений с поверхностей различных материалов.
- Процессы очистки воды: сильные кислоты используются для нейтрализации вредных соединений в воде и поддержания оптимального pH в системах очистки воды.
Слабые кислоты
Слабые кислоты диссоциируют в водном растворе только частично и обладают меньшей активностью по сравнению со сильными кислотами. Они находят применение в следующих областях:
- Фармацевтическая промышленность: слабые кислоты используются для создания различных лекарственных препаратов и регулирования pH в процессе производства.
- Пищевая промышленность: в пищевой промышленности слабые кислоты используются для регулирования кислотности продуктов и повышения их консервации.
- Косметическая промышленность: слабые кислоты часто входят в состав косметических средств для поддержания pH и обеспечения оптимальных условий для кожи и волос.
- Разработка катализаторов: слабые кислоты могут использоваться для создания катализаторов в химических процессах и реакциях.
Важно отметить, что выбор между сильной и слабой кислотой зависит от требуемого уровня активности, степени диссоциации и подходящей области применения.



