Изоэлектронными называют молекулы, в которых число электронов на внешнем энергетическом уровне одинаково. Этот факт позволяет сделать важные заключения о химических свойствах данных соединений и объяснить, почему они ведут себя подобным образом.
Один из примеров изоэлектронных молекул - азот (N2). Молекула азота состоит из двух атомов азота, каждый из которых имеет пять электронов на внешнем энергетическом уровне. Это делает молекулу азота стабильной и неподвижной, поскольку пары азотных атомов могут обмениваться только одним электроном для создания тройных связей.
Как и азот, оксид углерода (CO) также является изоэлектронной молекулой. В данном случае, карбонильный кислород обладает шестью электронами на внешнем энергетическом уровне. Такое количество электронов делает оксид углерода стабильным и реактивным в некоторых химических реакциях, таких как сияние в результате неправильного горения или воздействие на дыхательную систему.
Наконец, ацетилен (C2H2) также является изоэлектронной молекулой, состоящей из двух атомов углерода и двух атомов водорода. Оба атома углерода имеют четыре электрона на внешнем энергетическом уровне, а каждый атом водорода имеет один электрон на внешнем энергетическом уровне. Это обеспечивает стабильность и реактивность ацетилена и делает его важным веществом в производстве различных химических соединений, включая пластмассы и растворители.
Молекула азота: объяснение изоэлектронности
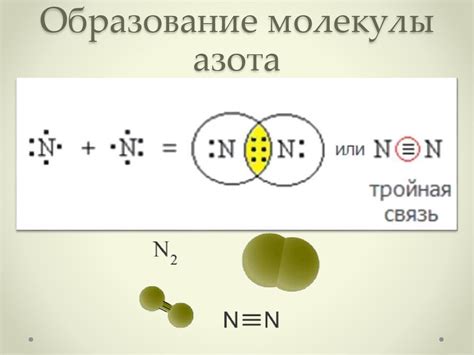
Молекула азота (N2) состоит из двух атомов азота, каждый из которых имеет по 7 электронов. Оба атома азота имеют электронную конфигурацию 1s2 2s2 2p3.
Для образования ковалентной связи между атомами азота оба атома могут делить свои электроны в своих внешних p-орбиталях. В результате образуется дополнительное молекулярное орбитальное пространство, в котором находятся 6 электронов -- 3 электрона от каждого атома.
Таким образом, в конечном итоге, молекула азота имеет 14 электронов: 7 электронов остаются у каждого атома, но 6 электронов располагаются в пространстве между двумя атомами, где они образуют 3 пары электроновых облаков (связи) -- так называемую тройную ковалентную связь.
Изоэлектронность молекулы азота заключается в том, что каждый атом азота вокруг себя имеет три пары электронов, что соответствует электронной конфигурации атома гелия (1s2), который является инертным газом и наиболее стабильным состоянием атома.
Изоэлектронность молекулы азота позволяет ей проявлять схожие химические свойства и реактивность с другими молекулами, содержащими тройные ковалентные связи, например, с ацетиленом (C2H2).
В то же время, изоэлектронность молекулы азота отличает ее от молекулы оксида углерода (CO), которая содержит двойную ковалентную связь и имеет электронную конфигурацию 1s2 2s2 2p2, что соответствует атому кислорода (O) и задает стабильное состояние.
Оксид углерода: почему он считается изоэлектронным

Оксид углерода считается изоэлектронным в связи с тем, что он имеет одинаковое число электронов в своей валентной оболочке, как и молекулы азота и ацетилена. Все эти молекулы имеют общую конфигурацию электронов: 2с2 2р2, что означает наличие двух электронов в субуровне s и двух электронов в субуровне p.
Изоэлектронность в молекулах азота, оксида углерода и ацетилена обусловлена тем, что каждый атом этих элементов стремится заполнить свою внешнюю оболочку электронами. Из-за этого они образуют валентные связи с другими атомами, чтобы достичь стабильной электронной конфигурации, аналогичной электронной конфигурации инертных газов.
Молекулы, являющиеся изоэлектронными, обладают схожими физическими и химическими свойствами, так как они содержат одинаковое число электронов и имеют схожую электронную конфигурацию. Это делает изоэлектронные молекулы полезными в химической реактивности и прогнозировании их поведения в различных окружающих условиях.
| Молекула | Электронная конфигурация |
|---|---|
| Азот (N2) | 2с2 2р2 |
| Оксид углерода (CO) | 2с2 2р2 |
| Ацетилен (C2H2) | 2с2 2р2 |
Ацетилен: причины его изоэлектронности

Изоэлектронность означает, что у молекул разных соединений одно и то же количество внешних электронов. В случае ацетилена и азота оба соединения содержат по 10 электронов в валентной оболочке. У оксида углерода также 10 внешних электронов, если считать две двойные связи и два связывающих электрона. Это позволяет этим молекулам иметь сходные свойства и образовывать схожие химические реакции.
Изоэлектронность ацетилена, оксида углерода и азота обуславливает их похожее химическое поведение и возможность участия в реакциях, таких как образование комплексов с другими соединениями или окисление взаимодействии с кислородом.
Молекула азота: изоэлектронность и атомный номер
Молекула азота (N2) состоит из двух атомов азота, связанных тройной ковалентной связью. Азот представляет собой неметаллический элемент, имеющий атомный номер 7 и электронную конфигурацию 1s2 2s2 2p3. Внешний электронный слой азота содержит пять электронов.
Изоэлектронность обозначает схожую электронную конфигурацию у различных атомов или молекул. Когда атомы или молекулы имеют одинаковое количество электронов, они считаются изоэлектронными. В случае молекулы азота, оба атома азота имеют такую же электронную конфигурацию, состоящую из трех электронов в p-орбиталях и двух электронов в s-орбиталях.
Атомный номер азота, равный 7, указывает на количество протонов в его ядре. Протоны имеют положительный заряд и определяют химические свойства атома. Кроме того, количество протонов в атоме также определяет его положение в таблице химических элементов - период и группу. В случае азота, его атомный номер 7 позволяет ему находиться во втором периоде и пятой группе.
Оксид углерода: связь с изоэлектронностью
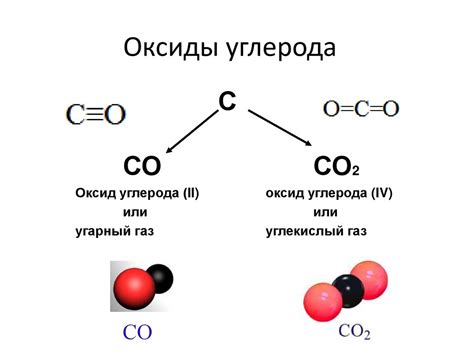
Каждый атом углерода в молекуле оксида углерода образует трехцентровую двухэлектронную связь с атомом кислорода. Эта особенная связь является ключевым фактором, объясняющим связь оксида углерода с изоэлектронностью.
Изоэлектронность азота, оксида углерода и ацетилена обусловлена тем, что все эти молекулы содержат 10 электронов в своей внешней оболочке. Это делает их структурно и электронно схожими и позволяет им проявлять сходные свойства и реакционную активность.
Оксид углерода, как и другие изоэлектронные молекулы, обладает несколькими важными свойствами. Так, с помощью оксида углерода возможна связь с ионами металлов, образуя их карбонатные соединения. Кроме того, оксид углерода может служить безводным окислителем и обладает способностью формирования связи с другими атомами.
Таким образом, изоэлектронность молекулы оксида углерода играет важную роль в ее химической природе и свойствах. Это позволяет объединять его с азотом и ацетиленом в тему, посвященную изоэлектронным молекулам.
Ацетилен: электронная структура и изоэлектронность
Атом углерода имеет 6 электронов, атом водорода - 1 электрон. В обычном состоянии ацетилен образует тройную связь между атомами углерода и две одинарные связи между атомами углерода и водорода. Это значит, что в молекуле ацетилена имеется 10 электронов.
Молекула азота (N2) содержит 7 электронов в каждом атоме, а молекула оксида углерода (CO) содержит 6 электронов в атоме углерода и 8 электронов в атоме кислорода.
Изоэлектронность базируется на том, что молекулы имеют одинаковое количество электронов, что делает их по сути схожими с точки зрения электронной структуры и связей между атомами.
Таким образом, ацетилен, азот и оксид углерода являются изоэлектронными молекулами благодаря схожей электронной структуре, что позволяет им обладать схожим поведением в реакциях и связанными соединениями с другими веществами.
Молекула азота: связь между электронами и изоэлектронностью
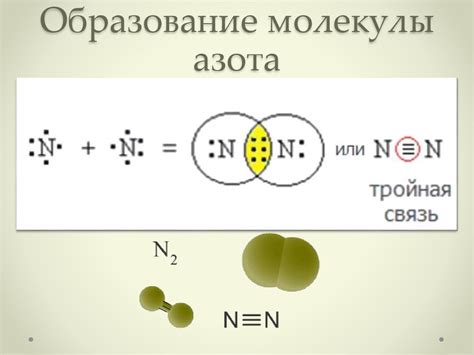
Молекула азота (N2) состоит из двух атомов азота, каждый из которых имеет пять электронов в валентной оболочке. Каждый атом образует тройную связь с другим атомом, обменяв при этом по три электрона. В результате образуется сильная валентная связь, обеспечивающая устойчивость молекулы азота.
| Молекула | Число электронов на внешней оболочке |
|---|---|
| Азот (N) | 5 |
| Оксид углерода (CO) | 4 |
| Ацетилен (C2H2) | 2 |
Оксид углерода (CO) содержит один атом углерода и один атом кислорода. Углерод имеет четыре электрона в валентной оболочке, а кислород имеет шесть. Для образования молекулы оксида углерода углерод обменивает два электрона с кислородом, образуя двойную связь. Это обеспечивает устойчивость данной молекулы.
Ацетилен (C2H2) содержит два атома углерода и два атома водорода. Углероды имеют по два электрона в валентной оболочке, а водороды по одному. Оба углерода образуют тройную связь между собой, обменяв по два электрона. Это обеспечивает устойчивость молекулы ацетилена.
Изоэлектронность молекул азота, оксида углерода и ацетилена позволяет им обладать схожими электронными свойствами и химической реактивностью. Понимание этой связи между электронами помогает в изучении и предсказании поведения различных молекул и соединений.
Оксид углерода: принцип изоэлектронности
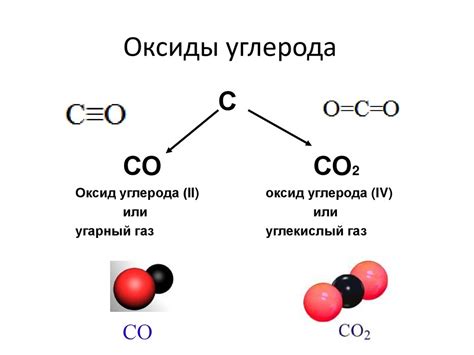
Принцип изоэлектронности заключается в том, что молекулы, состоящие из различных атомов, могут иметь одинаковое число электронов. Например, молекула азота содержит 14 электронов, а молекула CO также содержит 14 электронов (6 от углерода и 8 от кислорода). Это обусловлено тем, что атомы углерода, кислорода и азота имеют разное число электронов в своих внешних оболочках, но могут образовывать химические связи, чтобы достичь стабильности.
Молекула CO обладает стойкостью и имеет некоторые важные химические свойства. Например, она обладает способностью связываться с гемоглобином в крови, что может привести к сердечно-сосудистым проблемам. Кроме того, она является важным ингредиентом в химических процессах, таких как производство синтезного бензина.
| Молекула | Число электронов |
|---|---|
| CO | 14 |
| N2 | 14 |
| C2H2 | 14 |
Ацетилен: роль электронов в изоэлектронности
Ацетилен является изоэлектронным соединением, так как содержит 6 электронов в своей валентной оболочке, как и атом азота (N2) и оксид углерода (CO).
В ацетилене каждый атом углерода образует две σ-связи с двумя атомами водорода и одну π-связь с другим атомом углерода. Тройная связь в ацетилене имеет особое значение, так как позволяет молекуле быть несимметричной и обладать асимметричной геометрией. Это дает ацетилену уникальные свойства и позволяет использовать его в различных химических реакциях и промышленных процессах.
Изоэлектронные молекулы, такие как ацетилен, обладают сходным количеством электронов во внешней оболочке и, следовательно, имеют схожее химическое поведение. Это обусловлено тем, что электроны во внешней оболочке определяют химические свойства атомов или молекул.
Изоэлектронные соединения имеют важное значение в органической и неорганической химии, поскольку позволяют проводить сравнительный анализ и предсказывать химические свойства соединений на основании их структуры и электронной конфигурации.
Молекула азота: особенности изоэлектронной структуры

Атомы азота имеют по 7 электронов в своей валентной оболочке. Чтобы достичь стабильной октетной конфигурации, каждому атому азота нужно получить еще три электрона. В результате они образуют три связи между собой, обменяв по паре электронов. Таким образом, у каждого атома азота в молекуле образуется по две свободные пары электронов.
Изоэлектронные молекулы содержат одинаковое количество электронов, что позволяет им обладать схожими физическими и химическими свойствами. Молекула азота выступает в качестве электронного донора в химических реакциях, замещая свои связи на другие атомы или группы атомов.



