Когда мы смотрим на стакан с водой или на лист дерева, кажется, что эти предметы состоят из одной целой массы. Но на самом деле они состоят из молекул, которые неслипающимися и притягивающимися друг к другу частицами. Сила, которая держит их вместе, называется межмолекулярными силами. Чтобы понять, почему молекулы притягиваются, надо погрузиться в мир их микро-мир и изучить эти удивительные силы.
Межмолекулярные силы являются результатом взаимодействия электрических зарядов в молекулах. Эти силы возникают из-за отталкивания или притяжения зарядов различных молекул. В зависимости от полюсности и расстояния между молекулами, они могут быть притягивающими или отталкивающими. Но самая сильная из них - ван-дер-ваальсова сила, которая проявляется на малых расстояниях и отвечает за свойства газов, жидкостей и твердых тел.
Одной из причин, почему молекулы не слипаются, является силовое поле внутри каждой молекулы. Когда две молекулы сближаются, их силовые поля начинают взаимодействовать. Это взаимодействие создает притягивающую силу между молекулами. Ван-дер-ваальсова сила заключается в том, что эти молекулы могут быть временными диполями, т.е. они могут образовывать слабые магнитные поля, которые притягивают другие молекулы.
Почему молекулы притягиваются
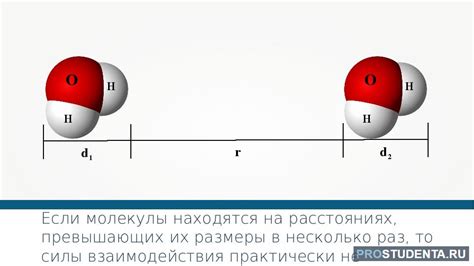
Ван-дер-ваальсово притяжение возникает благодаря флуктуациям электронов в атомах или молекулах. В результате этих флуктуаций в молекуле могут временно образовываться заряды, которые создают положительные и отрицательные области. Эти временные диполи взаимодействуют с другими молекулами и вызывают притяжение между ними.
Электростатическое взаимодействие основано на взаимодействии электрических зарядов. Если в молекуле одна область имеет положительный заряд, а другая – отрицательный, они притягиваются друг к другу. Это взаимодействие наблюдается, например, между положительно заряженными ядрами атомов и отрицательно заряженными электронами внутри атома.
Ковалентные связи возникают, когда два атома делят между собой электроны. В результате образуется пара электронов, которая обращается к обоим атомам. Это сильное взаимодействие приводит к образованию молекулы.
При совместном действии этих межмолекулярных сил молекулы притягиваются друг к другу, образуя различные агрегатные состояния вещества – газы, жидкости и твердые тела. Имея понимание причин притяжения молекул, мы можем объяснить многие свойства и поведение веществ в нашем мире.
Межмолекулярные силы объединяют частицы
Ван-дер-ваальсовы силы – это слабые силы притяжения между неполярными молекулами. Они возникают за счет временных колебаний зарядовых облаков молекул и приводят к образованию кратковременных диполей. Кроме внешних электрических полей, ван-дер-ваальсовы силы зависят от длины молекулы, ее формы и электронной структуры.
Диполь-дипольные взаимодействия возникают между полярными молекулами, у которых есть постоянный дипольный момент. В таких молекулах заряды неравномерно распределены, что создает электростатическое притяжение между ними. Силы притяжения пропорциональны дипольному моменту и расстоянию между молекулами.
Водородные связи являются особым типом диполь-дипольных взаимодействий. Они возникают между молекулами, у которых водороспределение атомов создает области положительного и отрицательного заряда. Водородные связи более сильны и устойчивы, чем обычные диполь-дипольные взаимодействия.
Межмолекулярные силы обусловливают массовое притягивание частиц вещества, придавая им структурированность. Они определяют состояние вещества и свойства материалов. Понимание межмолекулярных сил позволяет разрабатывать новые материалы с определенными свойствами и регулировать их поведение в различных условиях.
Важно отметить, что межмолекулярные силы не позволяют молекулам слипаться и образовывать однородную массу. Напротив, эти силы поддерживают определенное расстояние между частицами, обеспечивая стабильную структуру вещества. Если межмолекулярные силы становятся недостаточно сильными, частицы могут слипаться, что приводит к смене состояния вещества или образованию новых таких веществ.
Влияние электростатических сил на молекулы

Электростатические силы играют важную роль в притяжении и отталкивании молекул. Эти силы возникают из-за взаимодействия зарядов внутри молекулы и между различными молекулами. Электростатические силы могут быть притягивающими или отталкивающими, и их величина зависит от зарядов и расстояния между молекулами.
Внутри молекулы электростатические силы поддерживают атомы вместе. Электроны, заряженные отрицательно, притягивают положительно заряженные ядра атомов, что позволяет молекуле существовать в стабильном состоянии. Это электростатическое взаимодействие между зарядами препятствует слипанию молекул вещества.
Между различными молекулами также действуют электростатические силы. Положительные и отрицательные заряды на молекулах притягиваются, образуя слабые привязанные состояния, такие как водородные связи. Эти слабые связи играют важную роль в свойствах вещества, таких как кипение и плавление, позволяя молекулам оставаться разделенными, но одновременно взаимодействовать.
Однако электростатические силы могут быть и отталкивающими. Если две молекулы имеют одинаковый заряд, они отталкиваются друг от друга из-за электростатического отталкивания. Это помогает предотвратить сложение молекул и способствует поддержанию разделения между ними.
Влияние электростатических сил на молекулы является ключевым фактором в формировании структуры и свойств вещества. Благодаря этим силам молекулы могут взаимодействовать друг с другом, но при этом сохранять отдельность и предотвращать слипание.
Диполь-дипольное взаимодействие: причины притяжения
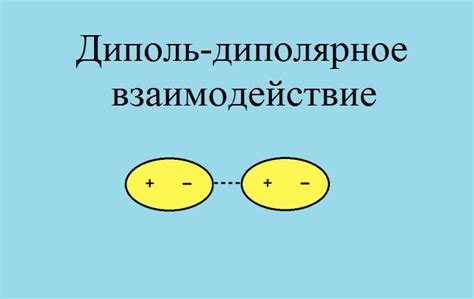
Диполь – это разделение зарядов в молекуле, когда обедненная электронами область приобретает частичный положительный заряд, а обогащенная электронами область – частичный отрицательный заряд. Такое разделение зарядов обусловлено наличием полярных связей между атомами внутри молекулы.
Когда две полярные молекулы находятся близко друг к другу, их диполи притягиваются друг к другу. Отрицательно заряженная область одной молекулы притягивает положительно заряженную область другой молекулы, и наоборот. Это притяжение создает силу, которая удерживает молекулы вместе, но не позволяет им слипаться.
Диполь-дипольное взаимодействие является существенным для объяснения многих свойств веществ, таких как поверхностное натяжение, температура кипения, растворимость и т. д. Кроме того, диполь-дипольное взаимодействие также может влиять на процессы химических реакций и биологические процессы в организмах.
| Примеры веществ, обладающих диполь-дипольным взаимодействием | Полярность |
|---|---|
| Вода | Полярное |
| Этиленгликоль | Полярное |
| Аммиак | Полярное |
| Сероводород | Полярное |
Роль ван-дер-ваальсовых сил в удержании молекул
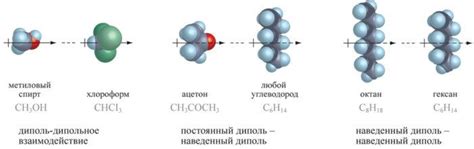
Роли ван-дер-ваальсовых сил в удержании молекул нельзя недооценивать, потому что они определяют многое. Они притягивают молекулы друг к другу и удерживают их на расстоянии, предотвращая их слипание. Это объясняет, почему молекулы удерживают свою форму и не сливаются в одну гигантскую структуру.
Ван-дер-ваальсовы силы обуславливают и свойства многих веществ. К примеру, они влияют на температуру плавления и кипения, плотность и вязкость веществ. Также они играют важную роль в биологических системах, где контролируют взаимодействие между молекулами белков, ДНК и других биомолекул.
Стремясь понять и изучить взаимодействие молекул и физические свойства веществ, ученые уделяют внимание ван-дер-ваальсовым силам. Благодаря их пониманию и контролю возможно создание новых материалов с желаемыми свойствами или улучшение уже существующих.
Гидрофобные взаимодействия, сохраняющие структуру
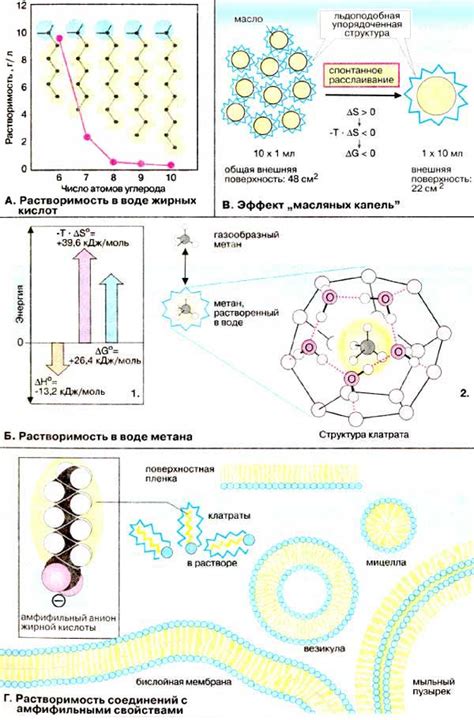
Гидрофобные взаимодействия играют ключевую роль в формировании и поддержании структуры биологических молекул, таких как белки и липиды. Например, в белковых молекулах гидрофобные аминокислоты часто скрыты внутри, формируя гидрофобное ядро, в то время как гидрофильные аминокислоты располагаются на поверхности и взаимодействуют с водой.
Молекулы, обладающие гидрофобными группами, имеют тенденцию объединяться друг с другом, так как это минимизирует их контакт с водой. Образующиеся гидрофобные взаимодействия между такими молекулами позволяют сохранять структуру и стабильность белковых комплексов и мембран, а также способствуют формированию гидрофобных кольцевых областей внутри молекул, играющих роль активных центров или мест связывания с другими молекулами.
Таким образом, гидрофобные взаимодействия играют важную роль в биологических и химических процессах, поддерживая структуру и функциональные свойства молекул. Они являются одним из факторов, определяющих взаимодействие молекул в живых системах.
Молекулярные связи и их роль в укладке веществ
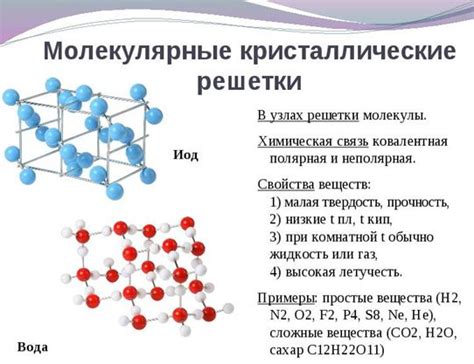
Существует несколько видов молекулярных связей, каждая из которых способна к формированию уникальной структуры. Ковалентная связь, например, образуется путем обмена электронами между атомами. Она обладает высокой прочностью и устойчивостью, поэтому доминирует в органических соединениях.
Ионные связи возникают между атомами с противоположными зарядами – катионами и анионами. Подобные связи обладают большой силой и могут образовывать кристаллические структуры, такие как соль или керамика.
Водородные связи образуются между водородом и другими электроотрицательными атомами, такими как кислород или азот. Они обладают слабой силой, но могут эффективно удерживать молекулы воды в жидком состоянии и создавать твердые структуры, такие как лед.
Ван-дер-ваальсовы силы являются слабыми притяжениями, возникающими между нейтральными молекулами. Эти силы играют важную роль в укладке молекул и взаимодействии между различными веществами.
Распределение и характер этих связей в материале определяют его физические и химические свойства. Например, ковалентные связи обуславливают прочность и твердость материалов, водородные связи влияют на их температуру плавления и испарения, а Ван-дер-ваальсовы силы определяют их текучесть и смачиваемость.
В итоге, связи между молекулами играют решающую роль в укладке веществ и формировании их структуры. Понимание этих связей и их взаимодействия важно для разработки новых материалов с определенными свойствами и для понимания физических и химических процессов, происходящих с веществом.



