Марганец и хлор - это элементы из разных групп периодической системы, и их свойства значительно отличаются друг от друга. Марганец относится к д-блоку периодической системы элементов и имеет атмосферу металлического элемента.
Марганец обладает металлическими свойствами, такими как блеск, хорошая теплопроводность и электропроводность. Он способен образовывать металлическую решетку с другими металлами, образуя сплавы. Это происходит из-за его электронной структуры, которая включает блок д-электронов, обеспечивающий свободное движение электронов.
С другой стороны, хлор относится к не-металлам и обладает неметаллическими свойствами. Хлор имеет высокую электроотрицательность и стремится получить дополнительные электроны, чтобы достичь стабильной электронной конфигурации. Вместо того, чтобы образовывать металлическую решетку, хлор образует ковалентные связи с другими не-металлами, образуя молекулы.
Выясним, почему марганец проявляет металлические свойства, а хлор - неметаллические

Различные элементы химического периодического стола обладают различными свойствами, которые определяются их структурой и взаимодействием атомов и молекул. Для объяснения различий в металлических и неметаллических свойствах марганца и хлора, необходимо рассмотреть их атомные и молекулярные структуры.
Марганец (Mn) является металлом, который расположен в блоке d периодической таблицы. Атом марганца имеет 25 электронов, расположенных в оболочках. Внешней оболочкой марганца является 3d54s2. Это означает, что у марганца есть два электрона в своей внешней оболочке, что обеспечивает ему высокую подвижность электронов и тем самым металлические свойства, такие как хорошая электропроводность и теплопроводность.
С другой стороны, хлор (Cl) - это неметалл, который находится в блоке p периодической таблицы. Атом хлора имеет 17 электронов, расположенных в оболочках. Внешней оболочкой хлора является 3p5. Это означает, что у хлора есть семь электронов в своей внешней оболочке, что приводит к тому, что он стремится получить или поделиться электроны с другими атомами, чтобы достичь стабильной октаэдрической конфигурации. Это ведет к образованию молекул, состоящих из двух атомов хлора, которые образуют сильные ковалентные связи, делая его неметаллом.
Таким образом, различия в металлических и неметаллических свойствах марганца и хлора обусловлены различием в их атомных и молекулярных структурах. Атом марганца имеет свободные электроны в своей внешней оболочке, что позволяет ему проявлять металлические свойства. В то же время, хлор образует ковалентные связи с другими атомами, формируя молекулы и проявляя неметаллические свойства.
Пропуская атомы через сетку
При определении металлических и неметаллических свойств элементов, важную роль играют их атомные структуры.
Металлы, такие как марганец, обладают металлическими свойствами благодаря специальной структуре и поведению их атомов.
С точки зрения электронной структуры, атомы марганца имеют много свободных электронов. Когда эти атомы сближаются, свободные электроны создают сеть, называемую "электронной оболочкой". Эта электронная сетка позволяет электронам свободно двигаться между атомами. Результатом являются металлические свойства марганца, такие как хорошая электропроводность, пластичность и блеск.
С другой стороны, неметаллические элементы, такие как хлор, имеют другую атомную структуру. Атомы хлора имеют высокую электроотрицательность и обычно образуют молекулы, состоящие из двух атомов (Cl2). Эти молекулы не образуют сеть электронов, что приводит к неметаллическим свойствам хлора, таким как плохая электропроводность и хрупкость.
Таким образом, различные атомные структуры и поведение электронов определяют металлические и неметаллические свойства элементов, таких как марганец и хлор.
Различия в электронной структуре

Марганец (Mn), находящийся в d-блоке периодической таблицы, имеет электронную конфигурацию [Ar] 3d5 4s2. Пяти электронам в подуровне d необходимо образовать ковалентные и металлические связи с другими атомами для достижения стабильности. Кроме того, наличие двух электронов в s-подуровне позволяет марганцу проявлять металлические свойства, такие как электропроводность и теплопроводность.
С другой стороны, хлор (Cl), находящийся в p-блоке периодической таблицы, имеет электронную конфигурацию [Ne] 3s2 3p5. В позиции хлора нет свободных d- или f-орбиталей, что делает его более склонным к образованию ковалентных связей. Более высокое количество электронов в подуровне p также позволяет хлору проявлять неметаллические свойства, такие как высокая электроотрицательность и отсутствие электропроводности.
Влияние внешних условий

Металлические свойства марганца тесно связаны с его внутренней структурой и электронной конфигурацией. Марганец имеет характерные свойства металлов, такие как хорошая электропроводность и теплопроводность. Его внешние условия, такие как высокая температура или низкое давление, могут влиять на его металлические свойства.
Однако неметаллические свойства хлора обусловлены его химическим составом и электронной структурой. Хлор является галогеном и образует молекулы, состоящие из двух атомов. Это делает его неметаллом с характерными свойствами, такими как низкая электропроводность и хрупкость.
Влияние внешних условий на свойства марганца и хлора может быть связано с изменением их электронной структуры или внутренней конфигурации атомов. Например, при низкой температуре марганец может стать хрупким и потерять свои металлические свойства. Хлор, напротив, может стать менее хрупким и проявить некоторые металлические свойства при определенных условиях.
Исследования влияния внешних условий на металлические и неметаллические свойства веществ помогают лучше понять их структуру и свойства в различных средах и условиях. Это важно для развития новых материалов и применения веществ в различных областях науки и промышленности.
Отличия в ионной форме

Когда марганец находится в металлической форме, он образует положительные ионы, так называемые катионы. В ионной форме эти ионы могут перемещаться в решении, образуя электрический ток и проявляя металлические свойства, такие как проводимость электричества и тепла.
С другой стороны, хлор находится в неметаллической форме и образует отрицательные ионы, называемые анионы. В ионной форме эти анионы не обладают свойствами металлов и не могут перемещаться в решении, поэтому хлор является неметаллом.
Таким образом, химическая структура элементов в ионной форме определяет их свойства, включая металлические и неметаллические свойства.
Разное положение в периодической таблице
Марганец проявляет металлические свойства из-за своей электронной конфигурации. Он имеет 25 электронов, распределенных по оболочкам с разными энергетическими уровнями. У первых 2 электронов есть возможность двигаться свободно, что позволяет марганцу проводить электрический ток и обладать металлическим блеском.
Хлор, в свою очередь, относится к неметаллам и проявляет неметаллические свойства. Электронная конфигурация хлора состоит из 17 электронов, разбитых на разные энергетические уровни. Хлор стремится заполнить свою внешнюю энергетическую оболочку, имеющую 7 электронов. Он готов образовывать ковалентные связи, принимая электроны от других элементов и образуя отрицательные ионы.
Таким образом, различие в электронной конфигурации и основных свойствах марганца и хлора объясняет их разное проявление металлических и неметаллических характеристик.
Электронные переходы между орбиталями

Марганец и хлор проявляют разные свойства из-за различия в электронной структуре атомов. Количество электронов, их распределение по энергетическим уровням и орбиталям в атоме определяют, какие химические связи они могут образовывать и какие свойства проявлять.
Марганец имеет атомный номер 25, что означает наличие 25 электронов. Они распределены по уровням K (2), L (8), M (13), N (2). Внешний энергетический уровень N содержит только 2 электрона, что делает марганец потенциально благоприятным для образования металлической связи. На уровнях K, L и M заняты все энергетические орбитали, и электроны заполнены по принципу ауфбау и правилу Гунда. Однако, из-за наличия нескольких электронов на последнем энергетическом уровне, марганец способен участвовать в химических реакциях и образовывать соединения с другими веществами.
Хлор имеет атомный номер 17 и содержит 17 электронов. Эти электроны распределены по уровням K (2), L (8), M (7). Внешний уровень M содержит несколько электронов, но не достаточно для образования металлической связи. Электроны на внешнем уровне создают сильную электростатическую силу притяжения к ядру и препятствуют образованию связи с другими атомами. Хлор, будучи неметаллом, склонен к образованию ковалентных связей, в которых электроны общего пула образуют пары и равномерно распределяются между прямо связанными атомами.
Таким образом, различия в электронной структуре атомов марганца и хлора обуславливают их различные химические свойства. Марганец, имея несколько электронов на последнем энергетическом уровне, способен образовывать металлическую связь и проявлять металлические свойства. Хлор, имея электроны на внешнем уровне, создает сильную электростатическую силу притяжения и образует ковалентные связи, обладая неметаллическими свойствами.
Исключение внешней оболочки
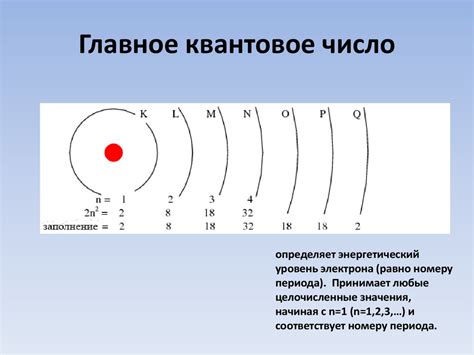
Металлические свойства марганца объясняются его внешней оболочкой. В атоме марганца на внешнем энергетическом уровне находятся 2 электрона, что делает его склонным к потере электронов и образованию катионов. Такая способность к образованию ионов марганца и является основой его металлических свойств. Кроме того, марганец обладает высокой электропроводностью и теплопроводностью.
Неметаллические свойства хлора связаны с его внешней оболочкой, состоящей из 7 электронов. Для достижения электронной стабильности хлор стремится получить один электрон, становясь анионом с отрицательным зарядом. Это делает хлор неметаллом с высокой силой окислителя и реактивностью. Хлор также обладает хорошей электрической проводимостью, но его теплопроводность невысока по сравнению с металлами.
Таким образом, металлические и неметаллические свойства марганца и хлора определяются их внешней оболочкой и способностью образования ионов.
Эффект тяжести

Металлические и неметаллические свойства химических элементов основаны на их атомной и молекулярной структуре. Однако, на поведение элементов также влияют внешние факторы, такие как температура и давление, а также эффект тяжести.
Эффект тяжести играет важную роль в проявлении металлических свойств. Металлы обладают высокой плотностью и поэтому их атомы или ионы тяготеют находиться ближе друг к другу. Это создает более благоприятные условия для образования и поддержания электронной оболочки с мобильными электронами. Именно мобильность электронов позволяет металлам проявлять металлические свойства, такие как проводимость электричества и тепла, а также пластичность и гибкость.
С другой стороны, неметаллы обычно имеют более низкую плотность и более слабую связь между атомами или молекулами. Это приводит к тому, что электроны в неметаллах остаются связанными с определенными атомами или молекулами и не могут свободно перемещаться. Результатом является неметаллическое поведение элементов, такое как непроводимость электричества и тепла, хрупкость и непластичность.
Эффект тяжести играет роль в проявлении металлических или неметаллических свойств не только на Земле, но и в космическом пространстве. В невесомости атомы или молекулы элементов не испытывают влияние силы тяжести и их поведение может измениться. Несмотря на это, в обычных условиях на Земле эффект тяжести оказывает значительное влияние на свойства марганца и хлора, делая их металлическими и неметаллическими соответственно.
| Свойства | Марганец (металл) | Хлор (неметалл) |
|---|---|---|
| Проводимость электричества | Высокая | Низкая |
| Проводимость тепла | Высокая | Низкая |
| Пластичность и гибкость | Высокая | Низкая |
| Хрупкость | Низкая | Высокая |



