Фазовый переход – это явление, которое происходит, когда вещество изменяет свою фазу, например, из жидкости в газ. В процессе испарения молекулы жидкости получают достаточно энергии, чтобы преодолеть силы притяжения друг к другу и перейти в газовую фазу. Зависимость между температурой и давлением при которых происходит фазовый переход называется кривой испарения.
Однако, у кривой испарения есть особая точка, называемая критической точкой, в которой она обрывается. Критическая точка характеризуется температурой и давлением, при которых газовая фаза и жидкостная фаза теряют различия между собой. В критической точке плотность газовой и жидкостной фаз становится одинаковой, а их вязкость и теплопроводность равны нулю.
Почему кривая испарения обрывается именно в критической точке? В этой точке притяжение между молекулами становится настолько сильным, что они не могут «оторваться» друг от друга и перейти в газовую фазу. Температура и давление в критической точке являются критическими значенями, которые позволяют молекулам оставаться связанными и сохранять жидкостную структуру.
Термодинамические процессы и кривая испарения
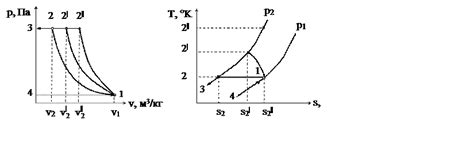
Термодинамический процесс, описываемый кривой испарения, начинается с точки на границе между двумя фазами (жидкой и газообразной), называемой критической точкой. В этой точке существует равновесие между фазами, и вещество может существовать как в жидкой, так и в газообразной форме. Однако при изменении давления или температуры вещество может пройти через критическую точку и изменить свое состояние.
При увеличении давления после критической точки кривая испарения обрывается, и вещество уже не может находиться в газообразном состоянии. Вместо этого оно переходит в жидкую фазу. Это объясняется тем, что при повышенном давлении молекулы вещества находятся очень близко друг к другу, и межмолекулярные силы становятся сильнее, что препятствует образованию газовой фазы.
Кривая испарения также обрывается при понижении температуры после критической точки. Это связано с тем, что при низкой температуре энергия молекул вещества снижается, и они не получают достаточно энергии для перехода в газообразное состояние. Вместо этого вещество остается в жидкой фазе.
Термодинамические процессы и кривая испарения демонстрируют важное влияние давления и температуры на поведение вещества. Понимание этих процессов помогает улучшить наши знания о фазовых переходах и использовании веществ в различных условиях.
| Давление | Температура |
|---|---|
| Выше критической точки | Может существовать как жидкость и газ |
| После критической точки | Может быть только жидким |
| Ниже критической точки | Может быть только жидким |
Фазовый переход и критическая точка
Критическая точка представляет собой особую точку на фазовой диаграмме, где происходит фазовый переход без изменения температуры и давления. В данной точке газ и жидкость становятся неразличимыми и образуют однородную фазу, называемую сверхкритической жидкостью.
В случае с кривой испарения, она обрывается в критической точке, так как при достижении этой точки граница между газом и жидкостью исчезает, и обе фазы сливаются в одну. При этом газ и жидкость теряют существенные различия в плотности и вязкости, что приводит к прекращению процесса испарения.
Совместные уравнения состояния газов

Уравнение состояния в физике и химии описывает связь между различными параметрами газового состояния. Существуют различные уравнения состояния, каждое из которых применимо в определенных условиях. Однако, для ряда веществ ни одно из классических уравнений состояния не работает во всех диапазонах температур и давлений. В таких случаях применяются совместные уравнения состояния.
Совместные уравнения состояния газов позволяют учесть различные физические явления, которые могут оказывать влияние на поведение газов в экстремальных условиях. Они учитывают влияние высоких давлений, больших температур, связей между молекулами и других факторов.
Одним из примеров совместных уравнений состояния является уравнение Ван-дер-Ваальса. Оно учитывает объем молекул и силы взаимодействия между ними, и позволяет описать поведение газов не только в области низких температур и давлений, но и вблизи критической точки. Вблизи критической точки кривая испарения обрывается, и уравнение Ван-дер-Ваальса способно описать это явление.
Другим примером совместного уравнения состояния является уравнение Редлиха-Квонга. Оно учитывает неидеальность газов, связи между молекулами и их пространственное расположение. Уравнение Редлиха-Квонга применимо для широкого диапазона веществ и хорошо описывает их поведение в различных условиях.
Совместные уравнения состояния газов являются более сложными и точными, чем классические уравнения состояния. Они позволяют описывать поведение газов в широком диапазоне параметров и учитывать особенности их молекулярной структуры. Это делает их необходимыми инструментами для исследования газов в экстремальных условиях и применения в различных областях науки и техники.
Критическая точка и обрыв кривой испарения
В критической точке происходят особые физические явления. Давление и температура, при которых эти явления происходят, называются критическими параметрами. Вещество переходит в критическую точку, когда его давление и температура достигают критических значений.
При приближении к критической точке кривая испарения становится всё более крутым, и наконец обрывается. Это происходит из-за особой структуры вещества в критической точке. На данном этапе вещество находится в критической фазе, состоящей из газовых и жидкостных частей, которые становятся неотличимыми друг от друга. Температура и давление в критической точке являются такими, что отличительные черты между газообразным и жидким состояниями исчезают.
Обрыв кривой испарения после критической точки означает, что вещество не может существовать в виде отдельных жидкостных и газообразных фаз при таких условиях. Оно переходит в так называемое сверхкритическое состояние, которое обладает свойствами как газа, так и жидкости, но не подчиняется обычным законам для них.
| Температура (Т) | Давление (Р) |
|---|---|
| Ниже критической точки | Твердое или жидкое состояние |
| Критическая точка | Обрыв кривой испарения |
| Выше критической точки | Сверхкритическое состояние |
Изучение кривой испарения и поведения вещества вблизи критической точки имеет важное значение для различных областей науки и техники, таких как химия, физика, нефтегазовая промышленность и другие. Понимание этого явления позволяет более точно предсказывать, как вещество будет вести себя в определенных условиях, а также разрабатывать методы и технологии его использования и контроля.
Критическая точка и границы фазовых диаграмм
Границы фазовых диаграмм – это области, которые разделяют различные фазы вещества. В пределах каждой фазы существуют уникальные значения физических свойств, таких как плотность, температура и давление. Переходы между фазами могут происходить при изменении температуры или давления.
Однако на фазовой диаграмме существуют определенные точки, где границы между фазами исчезают. Одной из таких точек является критическая точка. В этой области вещество переходит в свое особое состояние, называемое критическим состоянием. При этом границы между фазами теряют смысл и становятся неопределенными, что приводит к обрыву кривой испарения.
Критическая точка является важным показателем для изучения фазовых переходов вещества. В данной точке происходят особые физические и химические явления, связанные с изменением свойств вещества. Понимание критической точки и границ фазовых диаграмм позволяет нам лучше понять структуру и поведение различных веществ в условиях экстремальных температур и давлений.
Применение критической точки в технологиях

В промышленных технологиях критическую точку можно использовать для оптимизации процессов разделения смесей. При переходе через критическую точку происходят явления, связанные с изменением фазового состояния вещества, что позволяет эффективно разделять компоненты смеси.
Применение критической точки также широко распространено в суперкритической технологии. Вещество в суперкритическом состоянии обладает объединенными свойствами газа и жидкости, что делает его уникальным для решения сложных технологических задач. Суперкритическая технология находит применение, например, в процессах извлечения ценных веществ из растительного материала или очистки аэрозолей.
Благодаря особым свойствам вещества в критической точке, его можно использовать для создания новых материалов. Например, с помощью сверхкритической экстракции можно получать высокоэффективные экстракты для фармацевтической промышленности или изоляции биологически активных веществ.
Исследования критической точки также проводятся в области технологий хранения и транспортировки газов. Понимание поведения газа в критических условиях позволяет оптимизировать системы и снизить потери энергии.
Таким образом, критическая точка имеет очень важное значение в технологиях, позволяя разработать более эффективные процессы и создать новые материалы. Применение критической точки открывает широкие перспективы для инноваций и развития различных отраслей промышленности.



