Физические свойства газов и жидкостей вызывают особый интерес у ученых, которые пытаются понять, как именно работают различные вещества и почему они проявляют определенные свойства. Один из вопросов, ответ на который можно найти в области газов и жидкостей, - это почему газы можно сжать сильнее, чем жидкости.
Для начала давайте рассмотрим физические свойства газов и жидкостей. Газы, по определению, являются веществами, которые не имеют определенной формы и объема, и они могут легко расширяться и сжиматься под воздействием давления. Жидкости, в свою очередь, обладают определенной формой и объемом, но также способны расширяться и сжиматься.
Однако, газы могут сжиматься сильнее, чем жидкости, поскольку межатомные и межмолекулярные силы в газах гораздо слабее, чем в жидкостях. Это значит, что атомы или молекулы в газе могут смещаться относительно друг друга гораздо свободнее, чем в жидкости. В результате, приложение давления к газу приводит к его сжатию, поскольку атомы или молекулы смещаются ближе друг к другу.
Почему газы сжимаются сильнее, чем жидкости

1. Интермолекулярные силы. В газах между частицами существуют слабые взаимодействия, которые можно преодолеть при сжатии. Это объясняется тем, что газы имеют большое пространство между частицами и малую плотность. Жидкости, напротив, имеют более близкое расположение частиц, что обусловливает их более сильные взаимодействия.
2. Межмолекулярное расстояние. В газовом состоянии частицы находятся на большом расстоянии друг от друга и движутся хаотически. В результате расстояние между частицами в газе гораздо больше, чем в жидкости. Из-за этого газы могут быть сильнее сжаты, поскольку есть больше места для коллизий между молекулами.
3. Пространство между частицами. В газах межчастичные пространства очень большие, что дает возможность сжатия и уменьшения объема газа. В жидкостях же пространство между частицами значительно меньше, что ограничивает возможность сжатия.
Итак, газы сжимаются сильнее, чем жидкости, из-за слабых интермолекулярных сил, большого межмолекулярного расстояния и пространства между частицами. Эти особенности газов позволяют им быть более поддающимися сжатию веществами по сравнению с жидкостями.
Простота движения молекул в газах

В газе молекулы находятся в постоянном хаотичном движении, перемещаясь во все стороны со случайными скоростями. Межмолекулярные силы притяжения в газах обычно слабы, позволяя молекулам находиться на больших расстояниях друг от друга и свободно перемещаться.
Это движение молекул в газе делает его более сжимаемым по сравнению с жидкостью. В жидкости молекулы находятся ближе друг к другу и обладают большей взаимодействующей энергией. Это создает сильные силы притяжения и делает жидкость менее сжимаемой.
Простота движения молекул в газах позволяет им занимать большие объемы при низкой плотности. Это также объясняет, почему газы могут сильнее сжиматься, их объем может существенно уменьшаться при давлении или изменении температуры.
Важно отметить, что не все газы одинаковы по сжимаемости. Факторы такие как масса и размеры молекул, атмосферное давление и температура также оказывают влияние на сжимаемость газов. Однако простота движения молекул в газах остается ключевым фактором, обеспечивающим их большую сжимаемость по сравнению с жидкостями.
Межмолекулярные силы в газах и жидкостях
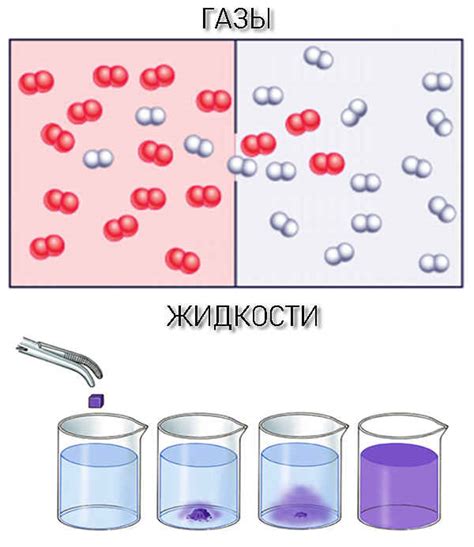
Межмолекулярные силы играют важную роль в физических свойствах газов и жидкостей. Они определяют, насколько легко можно сжать или расширить вещество. Газы и жидкости отличаются величиной и характером межмолекулярных сил.
В газах межмолекулярные силы слабы и преобладают дисперсионные (ван-дер-ваальсовы) силы. Эти силы возникают за счет неравномерного распределения электронов в молекулах газа. Они являются причиной возникновения моментных диполей и временных взаимодействий между молекулами. Из-за слабости межмолекулярных сил в газах они могут быть сжаты сильнее жидкостей.
В жидкостях межмолекулярные силы сильнее и могут быть разных типов: ван-дер-ваальсовы силы, диполь-дипольные взаимодействия и водородные связи. Ван-дер-ваальсовы силы встречаются во всех жидкостях и являются результатом неравномерного распределения электронов в молекулах. Диполь-дипольные взаимодействия возникают между молекулами, у которых есть постоянный дипольный момент. Водородные связи - это особый тип диполь-дипольных взаимодействий, которые возникают между молекулами, содержащими атомы водорода, связанные с электроотрицательными атомами.
Сильные межмолекулярные силы в жидкостях делают их труднее сжимаемыми по сравнению с газами. Жидкости обычно несжимаемы и имеют гораздо большую плотность, чем газы. Сжатие жидкости требует значительной внешней силы, так как молекулы жидкости уже находятся ближе друг к другу и взаимодействуют сильнее.
Таким образом, различные типы межмолекулярных сил влияют на сжимаемость газов и жидкостей. Слабые межмолекулярные силы в газах позволяют сжимать их сильнее, в то время как сильные межмолекулярные силы в жидкостях делают их менее сжимаемыми.
Молекулярный размер и расстояние между молекулами в газах и жидкостях

В газах межмолекулярное расстояние значительно превышает молекулярный размер. Это означает, что молекулы газов находятся на достаточно большом расстоянии друг от друга и свободно движутся в пространстве. При сжатии газа молекулы сближаются, но между ними остается достаточно свободного пространства. Это обусловливает высокую сжимаемость газов и возможность их сильного сжатия.
В жидкостях молекулярный размер сравним с межмолекулярным расстоянием. Молекулы жидкости находятся ближе друг к другу и образуют структуру, где расстояние между молекулами значительно меньше, чем в газе. При сжатии жидкости расстояние между молекулами остается примерно постоянным из-за сил притяжения между ними. Это делает жидкости менее сжимаемыми по сравнению с газами.
Таким образом, различия в плотности и сжимаемости газов и жидкостей обусловлены разницей в молекулярной структуре и расстоянии между молекулами. Газы, с их более свободной структурой и большим расстоянием между молекулами, могут быть сжаты сильнее, в то время как жидкости с их более плотной структурой и меньшим расстоянием между молекулами более сложно сжать.
Зависимость сжимаемости газов и жидкостей от давления и температуры
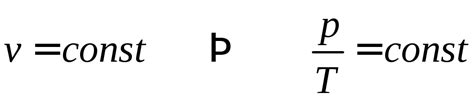
Сжимаемость газов гораздо выше, чем у жидкостей, что объясняется их молекулярной структурой. В газах между молекулами существует большое расстояние, поэтому их молекулы могут перемещаться свободно и значительно сжиматься под действием внешней силы. В жидкостях межмолекулярные связи сильнее, и молекулы находятся ближе друг к другу, поэтому сжатие жидкостей требует значительно большего усилия.
Зависимость сжимаемости газов от давления может быть описана законом Бойля-Мариотта. Согласно этому закону, при постоянной температуре объем газа обратно пропорционален давлению, т.е. при увеличении давления объем газа уменьшается, а при уменьшении давления - увеличивается. Этот закон позволяет сжимать газы до очень малых объемов при очень высоких давлениях.
Сжимаемость жидкостей также зависит от давления, но эта зависимость не так выражена, как у газов. Закон сжимаемости жидкостей является нелинейным и может быть описан несколькими уравнениями состояния. При повышении давления объем жидкости сжимается, но это происходит настолько медленно, что для сжатия жидкости требуется огромное давление.
Температура также оказывает влияние на сжимаемость газов и жидкостей. При повышении температуры сжимаемость газов увеличивается, а сжимаемость жидкостей снижается. Молекулы газов при нагревании движутся быстрее и сильнее раздвигаются, что делает их более сжимаемыми. В жидкостях при повышении температуры происходит возрастание межмолекулярных взаимодействий, что затрудняет их сжатие.
В итоге, сжимаемость газов и жидкостей зависит от давления и температуры, причем газы обладают гораздо более высокой сжимаемостью по сравнению с жидкостями. Это связано с различиями в молекулярной структуре и свойствах этих двух фаз вещества.



