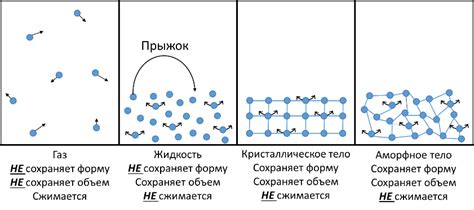
В нашей повседневной жизни мы имеем дело с различными видами веществ: твердыми, жидкими и газообразными. В то время как твердые и жидкие вещества могут иметь определенную форму и объем, газы, напротив, обладают высокой степенью подвижности и легко меняют свою форму и объем в соответствии с окружающими условиями.
Одним из наиболее фундаментальных свойств газов является их легкость сжимаемости. Это означает, что газы могут значительно уменьшаться в объеме под воздействием давления. Но почему это происходит? Объяснение этого явления можно найти в молекулярно-кинетической теории, которая рассматривает газы на уровне отдельных молекул.
Согласно молекулярно-кинетической теории, газ состоит из молекул, которые находятся в постоянном движении. Между молекулами действуют слабые силы притяжения, и в то же время молекулы обладают кинетической энергией, приводящей их в постоянное движение. Когда газ подвергается давлению, молекулы сближаются и могут быть сжаты, что приводит к уменьшению объема газа.
Причина легкой сжимаемости газов: молекулярно-кинетическая точка зрения
Все вещества состоят из молекул, которые постоянно движутся. В газах молекулы движутся быстро и хаотично, сталкиваясь друг с другом и со стенками сосуда. Именно эти столкновения молекул создают давление газа.
Молекулы газа находятся на значительном расстоянии друг от друга. Вакуумное состояние, когда межмолекулярное расстояние достаточно большое, может быть приближено к реальности газов. Когда к газу применяется сила, например, когда на него действует компрессия, молекулы начинают сближаться, тем самым уменьшая объем газа.
Молекулы газа обладают значительным количеством свободного места для перемещения, в силу своих энергетических состояний. При сжатии газа молекулы движутся более интенсивно и часто сталкиваются друг с другом и со стенками сосуда. Таким образом, молекулярные столкновения становятся более сильными и влияют на давление газа. В итоге давление газа увеличивается, а объем сокращается.
Из молекулярно-кинетической точки зрения, легкая сжимаемость газов объясняется значительным расстоянием между молекулами и их свободным движением, которое позволяет им без препятствий сближаться и отдаляться друг от друга.
| Преимущества | Недостатки |
|---|---|
| Большой объем | Легко распространяются |
| Простота сжатия | Малая плотность |
| Высокая подвижность | Малая теплопроводность |
Движение молекул газа
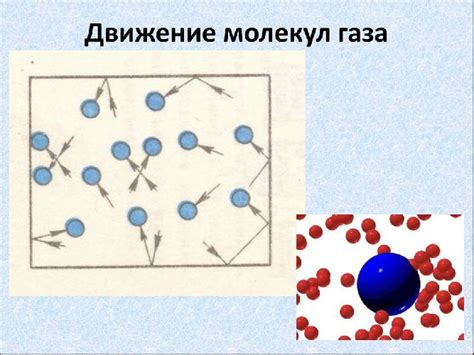
Молекулы газа постоянно движутся в случайных направлениях и со случайными скоростями. Это движение обусловлено тепловыми флуктуациями в газе. В результате столкновений между молекулами и со стенками сосуда, в котором находится газ, происходит обмен импульсом. Эти столкновения создают силу, вызывающую давление газа на стенки сосуда.
Движение молекул газа можно представить как случайное блуждание. Молекулы двигаются во всех направлениях, сталкиваются друг с другом и меняют свои направления движения. Из-за этого случайного движения молекул газа сжимаемость газа значительно выше, чем у жидкостей и твердых тел.
| Свойство движения молекул газа | Описание |
|---|---|
| Случайное движение | Молекулы газа двигаются в случайных направлениях и со случайными скоростями. |
| Столкновения | Молекулы газа сталкиваются друг с другом и со стенками сосуда, вызывая давление газа. |
| Импульс | При столкновениях молекулы обмениваются импульсом, создавая силу, вызывающую давление газа. |
Из-за свойств движения молекул газа, он легко сжимается. Если на газ действует давление, молекулы начинают сближаться, сокращая пространство между ними. В то же время молекулы постоянно двигаются, что препятствует полному сближению и удерживает газ в сжатом состоянии.
Поэтому, газы имеют высокую сжимаемость и занимают значительно больший объем при низком давлении, чем при высоком давлении. При увеличении давления молекулы газа сближаются, уменьшая пространство между ними, и уменьшается объем занимаемого газом.
Молекулярные силы в газах
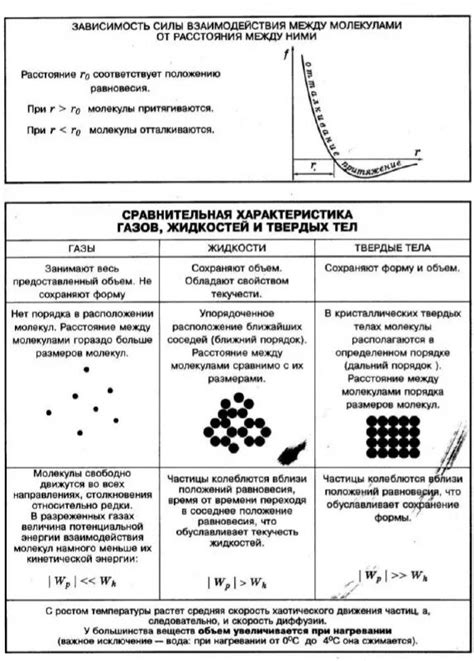
Газы можно считать идеальными, так как их молекулы взаимодействуют друг с другом только случайными ударами без каких-либо сил吗. Однако, в реальности, молекулы газа могут также испытывать слабые межмолекулярные силы.
В газовом состоянии, молекулы свободно движутся в разных направлениях с высокой скоростью и совершают беспорядочные столкновения. Межмолекулярные силы владеют только на крайнем близком расстоянии и слабо сказываются на движении молекул.
Существуют три основных типа межмолекулярных сил в газах: ван дер Ваальсовы силы, диполь-дипольные силы и силы водородной связи. Ван дер Ваальсовы силы возникают из-за непостоянства электронной оболочки атомов или молекул и являются слабейшими.
Диполь-дипольные силы возникают между полярными молекулами, имеющими неравномерное распределение электронной плотности и образующие полюса с положительным и отрицательным зарядами. Они немного сильнее ван дер Ваальсовых сил и могут влиять на физические свойства газа.
Наиболее сильные межмолекулярные силы в газах называются силами водородной связи. Они возникают между молекулами, содержащими атомы водорода, способные создавать связь с электронными облаками других атомов или молекул. Эти силы обладают высокой энергией связи и играют важную роль в химических реакциях и особых свойствах воды, аммиака и многих других соединений.
Однако, в общем случае, молекулярные силы в газах очень слабые по сравнению с кинетической энергией молекул, поэтому газы легко сжимаемы и занимают большие объемы при низком давлении.



