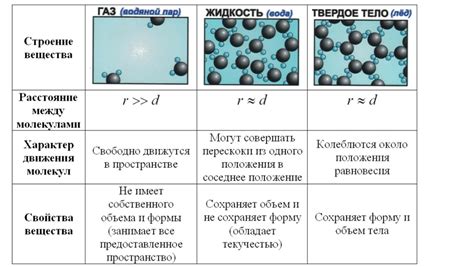
В природе существует три состояния вещества: твердое, жидкое и газообразное. Одним из основных свойств газа является его способность занимать весь доступный объем. Это значит, что вне зависимости от формы и размера сосуда, газ равномерно и полностью заполняет его. Но почему так происходит? В данной статье мы рассмотрим основные причины и механизмы распределения газа.
В основе способности газа занимать всю доступную область лежит два основных фактора: низкая плотность и высокая подвижность его частиц. Газовые молекулы обладают очень низкой массой и занимают большой объем по сравнению с твердыми или жидкими частицами. Это означает, что при одинаковом количестве вещества объем газа будет значительно больше, чем объем твердого или жидкого вещества. Благодаря этому газ способен заполнять все свободное пространство в сосуде.
Второй фактор, обеспечивающий равномерное распределение газа, - высокая подвижность его частиц. Молекулы газа непрерывно движутся во всех направлениях и сталкиваются между собой и со стенками сосуда. Такие столкновения приводят к перемешиванию молекул газа и их равномерному распределению по всему объему сосуда.
Таким образом, сочетание низкой плотности и высокой подвижности частиц газа обеспечивает его способность занимать весь объем сосуда. Это явление широко используется в различных областях, таких как химия, физика и технические науки. Понимание причин и механизмов распределения газа помогает нам лучше изучать и использовать его свойства на практике.
Взаимодействие молекул газа
В газообразном состоянии молекулы газа находятся в постоянном движении, сталкиваются друг с другом и взаимодействуют. Эти взаимодействия играют важную роль в создании равномерного распределения газа по всему объему.
Основные силы взаимодействия между молекулами газа - это силы ван-дер-ваальса. Эти силы возникают из-за временных изменений в распределении электронов в молекулах газа и создают временные диполи. Временные диполи притягивают молекулы друг к другу и обеспечивают их близкое расположение.
Кроме сил ван-дер-ваальса, молекулы газа также могут взаимодействовать через столкновения. Если молекула газа сталкивается с другой молекулой, она может передать ей энергию и импульс, что приводит к перемешиванию молекул в газовой среде.
В результате всех этих взаимодействий между молекулами газа происходит равномерное распределение молекул по всему объему. Молекулы газа не притягиваются к определенным точкам или поверхностям, а постоянно движутся и сталкиваются между собой, что позволяет газу занимать весь доступный объем.
Причины равномерного распределения газа

Газы, в отличие от жидкостей и твердых тел, обладают свойством равномерного распределения по доступному объему. Это связано с особыми свойствами газовых молекул и межмолекулярными взаимодействиями.
Основной причиной равномерного распределения газа является случайное движение газовых молекул. Газовые молекулы постоянно колеблются и перемещаются в разных направлениях со случайными скоростями. В результате этого движения молекулы заполняют доступный объем без исключения отдельных участков.
Еще одной причиной равномерного распределения газа является отсутствие сил притяжения или отталкивания между газовыми молекулами на больших расстояниях. Под действием только сил теплового движения молекулы равномерно заполняют весь объем, распределяясь в пространстве.
Другим фактором, способствующим равномерному распределению газа, является возможность газовых молекул пролетать сквозь другие молекулы без взаимодействия с ними. Газовые молекулы являются малыми по размеру и взаимодействуют между собой лишь при столкновениях. При этом, столкновения происходят настолько часто и быстро, что газовые молекулы успевают пронизывать друг друга, формируя равномерное распределение.
Итак, по причине случайного движения молекул, отсутствия значительных взаимодействий на больших расстояниях и возможности проникать друг сквозь друга, газы равномерно заполняют все доступные объемы, обеспечивая равномерное распределение по пространству. Это является характерным свойством газов, которое находит применение во многих процессах и технологиях.
Кинетическая теория и объем газа

Для понимания механизма и причин распределения газа по всему доступному объему необходимо обратиться к кинетической теории.
Согласно кинетической теории, газ состоит из молекул, которые движутся хаотически и сталкиваются друг с другом и со стенками сосуда. При этом, молекулы порождают давление, создают тепло и заполняют весь доступный им объем.
Для объяснения того, почему газ занимает весь объем, можно использовать следующие ключевые элементы:
- Молекулярный размер: молекулы газа обладают определенным размером, который может быть сравним с размерами сосуда, в котором газ находится. При условии, что молекулы находятся в постоянном движении, их траектории будут пересекаться и сталкиваться друг с другом и со стенками сосуда, препятствуя другим молекулам занять тот же участок пространства.
- Неупругие столкновения: при столкновении молекулы могут передавать друг другу энергию и двигаться в другом направлении. Это позволяет молекулам газа перемещаться по всему объему сосуда.
- Закон сохранения энергии: энергия, которую молекулы теряют при столкновениях, переходит в другие формы, такие как тепло. Передача энергии между молекулами позволяет поддерживать их движение и равномерное распределение по всему доступному объему.
Таким образом, благодаря кинетической теории молекулярного движения и взаимодействия, газ занимает весь доступный ему объем и равномерно распределяется по всему пространству сосуда.



