Фенолфталеин – один из самых популярных индикаторов, используемых в химических реакциях. Этот органический соединение обладает яркой розовой окраской в щелочной среде, и поэтому широко применяется для определения pH растворов. Однако, в процессе химической реакции, фенолфталеин может обесцветиться, что часто вызывает удивление и интерес у химиков и студентов.
Причина обесцвечивания фенолфталеина заключается в изменении его молекулярной структуры в процессе реакции. В растворах с нейтральным или кислым pH фенолфталеин находится в форме ионов, окрашенных в розовый цвет. Однако при постепенном изменении pH в щелочную область, ионы фенолфталеина превращаются в другие молекулы, которые не обладают цветом.
Обесцвечивание фенолфталеина является результатом конкретных реакций, происходящих в молекуле. Взаимодействие фенолфталеина с щелочными растворами приводит к образованию основания, которое вызывает изменение молекулярной структуры ионов фенолфталеина. Форма ионов, отвечающая за окраску, превращается в неокрашенные молекулы, что и приводит к обесцвечиванию раствора.
Почему фенолфталеин обесцвечивается?
Главной причиной обесцвечивания фенолфталеина является изменение окружающей среды и изменение pH. Фенолфталеин имеет две основные формы – кислую и щелочную, которые имеют разные цвета. В кислой среде фенолфталеин остается безцветным, а в щелочной среде приобретает интенсивный фиолетовый цвет.
Когда фенолфталеин добавляется в кислую среду, он остается безцветным, так как кислотная среда подавляет возможность фенолфталеина изменять свою структуру и цвет. Однако, если к реакционной смеси добавить достаточное количество щелочи, pH среды начинает увеличиваться.
При увеличении pH, фенолфталеин начинает затрагивать свою щелочную форму. В результате изменения своей структуры, связи между атомами, вещество теряет способность поглощать и отражать видимый свет, что приводит к обесцвечиванию.
Таким образом, обесцвечивание фенолфталеина является результатом изменения pH среды и перехода соединения из своей щелочной формы в безцветную кислую форму.
Сущность фенолфталеина
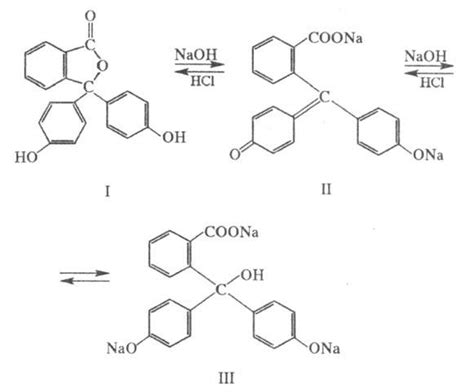
Структурно фенолфталеин представляет собой сложное органическое соединение, содержащее фенольное кольцо и две молекулы ацидной формы. Из-за такой структуры, фенолфталеин образует разные цветные и безцветные формы в зависимости от рН раствора.
В нейтральном и щелочном растворах фенолфталеин принимает красный цвет, а в кислых растворах обесцвечивается. Это связано с тем, что при взаимодействии фенолфталеина с щелочами, образуется анионная форма, которая имеет красный цвет. В кислых условиях эта анионная форма не образуется, и фенолфталеин остается в безцветной форме.
В результате, фенолфталеин используется в качестве индикатора при титровании кислот и щелочей. При добавлении фенолфталеина в раствор, его цвет изменяется в зависимости от того, когда происходит нейтрализация раствора. Когда весь раствор становится нейтральным или щелочным, фенолфталеин окрашивается в красный цвет, что сигнализирует об окончании титрования.
| рН | Цвет фенолфталеина |
|---|---|
| Менее 0 | Безцветный |
| 0-7 | Безцветный |
| 7-14 | Красный |
Взаимодействие реагента с веществами

Одной из причин обесцвечивания фенолфталеина является его окисление. Некоторые сильные окислители, такие как перманганат калия или хлор, могут привести к разрушению молекулы фенолфталеина, что приводит к его обесцвечиванию.
Кроме того, некоторые вещества могут взаимодействовать с фенолфталеином и образовывать комплексные соединения, что также может приводить к его изменению цвета или обесцвечиванию. Например, реакция фенолфталеина с железом может привести к образованию нерастворимого осадка, который отделяется от раствора и приводит к обесцвечиванию.
Таким образом, реакция фенолфталеина с различными веществами может привести к его обесцвечиванию. Это необходимо учитывать при использовании фенолфталеина как индикатора в химических реакциях.
Образование новых соединений

Фенолфталеин сам по себе имеет красный цвет, но при взаимодействии с окислителем, фенолфталеин окисляется и образует новое соединение с более высокой степенью окисления. Это новое соединение не имеет цвета или имеет другой цвет, что приводит к обесцвечиванию раствора с фенолфталеином.
Этот процесс может происходить по-разному в зависимости от окислителя и условий реакции. Например, в кислой среде фенолфталеин может окисляться до бензохинона, который не имеет цвета. В щелочной среде фенолфталеин может окисляться до диэтилгидроксиламина, который также не имеет цвета.
Таким образом, образование новых соединений в результате реакции с окислителем приводит к обесцвечиванию фенолфталеина.
Специфика физико-химических свойств

Одной из основных причин обесцвечивания фенолфталеина является изменение pH окружающей среды. Это происходит из-за того, что фенолфталеин - слабая кислота, и его окрашенная форма существует при низком pH. При повышении pH реакции, фенолфталеин претерпевает структурные изменения, в результате чего он переходит в безцветную форму.
Фенолфталеин также обладает свойством изменять цвет в зависимости от окружающей среды. Он хорошо растворим в спиртах и летучих органических растворителях, что делает его удобным индикатором в кислотно-основных титрациях.
Важно отметить, что фенолфталеин является лабораторным индикатором и необходимо соблюдать меры предосторожности при его использовании. Также стоит учесть, что применение фенолфталеина может быть ограничено его токсичностью и канцерогенными свойствами.
Влияние окружающей среды

Окружающая среда, в которой происходит реакция с фенолфталеином, может оказывать значительное влияние на его обесцвечивание.
Один из факторов, влияющих на изменение цвета фенолфталеина, - это растворитель, в котором он находится. Фенолфталеин лучше растворяется в водных средах, поэтому вода может способствовать его обесцвечиванию более эффективно, чем другие растворители.
Также pH окружающей среды может влиять на цвет фенолфталеина. В кислой среде (pH 8) он образует основные соединения и приобретает ярко-розовый цвет. Поэтому, если реакция с фенолфталеином происходит в щелочной среде, то его обесцвечивание может быть затруднено.
Температура также может оказывать влияние на обесцвечивание фенолфталеина. При повышении температуры реакция может протекать быстрее, что может способствовать его обесцвечиванию.
| Факторы окружающей среды | Влияние на обесцвечивание фенолфталеина |
|---|---|
| Растворитель | Растворение в водных средах способствует обесцвечиванию |
| pH | Кислая среда (pH 8) - нет | Температура | Повышение температуры может ускорить обесцвечивание |
Концентрация и pH раствора

Концентрация раствора отражает количество растворенного вещества в единице объема раствора. При низкой концентрации фенолфталеина в растворе, его молекулы могут не взаимодействовать достаточно активно, что снижает вероятность образования окрашенного комплекса. Поэтому при низкой концентрации может наблюдаться слабое или отсутствующее обесцвечивание раствора.
pH раствора - это мера его кислотности или щелочности. При значительном изменении pH в направлении кислоты или щелочи, свойства молекул фенолфталеина, включая его способность к образованию окрашенных комплексов, могут измениться. Например, при нейтральном pH фенолфталеин образует окрашенный комплекс, который делает раствор розовым или фиолетовым. Однако при щелочной реакции фенолфталеин переходит в безцветное состояние.
Окисление и восстановление
Окисление и восстановление являются важными реакциями в химии и играют важную роль во многих процессах. В рамках данной темы мы рассмотрим, как окисление и восстановление влияют на свойства фенолфталеина.
Окисление – это процесс, в результате которого атомы или ионы теряют электроны. Восстановление, напротив, представляет собой процесс, в ходе которого атомы или ионы приобретают дополнительные электроны.
Фенолфталеин обладает способностью образовывать разнообразные оксидационные состояния, что является основой для его использования в качестве индикатора. В присутствии окислителей, таких как пероксиды или хлор, фенолфталеин окисляется, приводя к образованию цветного оксидного соединения и демонстрации окрашенного раствора.
Однако, при восстановлении фенолфталеина вследствие добавления в восстановителя, например, гидроксида натрия, образуется безцветное соединение. Этот процесс обесцвечивания фенолфталеина позволяет использовать его в титрационных реакциях для точного определения концентрации кислот или щелочей.
Таким образом, способность фенолфталеина окрашиваться и обесцвечиваться при окислении и восстановлении связана с его структурой и электронной конфигурацией молекулы.
Химические реакции

Химические реакции могут быть различных типов, включая синтез, разложение, замещение, окисление и восстановление. Каждый тип реакции имеет свои особенности и требует определенных условий для своего протекания.
Одной из химических реакций, которая привлекает внимание исследователей, является реакция обесцвечивания фенолфталеина. Фенолфталеин - это индикатор, который используется для определения кислотности или щелочности растворов. Он имеет красный цвет в щелочных растворах и безцветен или слаборозовый в кислых средах.
Обесцвечивание фенолфталеина происходит при реакции с кислотой. В результате этой реакции происходит изменение структуры молекулы фенолфталеина, что приводит к изменению его спектральных свойств. Фенолфталеин перестает поглощать свет определенной длины волны, что приводит к его обесцвечиванию.
Реакция обесцвечивания фенолфталеина является обратимой, то есть он может обратно изменить свой цвет при реакции с щелочью. Это свойство фенолфталеина позволяет использовать его в качестве индикатора кислотно-щелочного равновесия и в ряде других химических исследований.
Изучение химических реакций является важным прекурсором для понимания различных процессов, происходящих в природе и обществе. Оно позволяет предсказать результаты реакций, создавать новые соединения и материалы, а также разрабатывать новые методы синтеза и применения химических веществ.
Катализаторы реакции
При этой реакции в качестве катализаторов могут выступать различные соединения, в основном, это сильные кислоты, такие как соляная кислота (HCl). Катализаторы играют важную роль в химической реакции, ускоряя ее протекание, но при этом сами не расходуются.
Кислоты катализируют обесцвечивание фенолфталеина, так как они обладают способностью донорства протона (H+) и активно взаимодействуют с молекулами фенолфталеина. В результате этой реакции происходит изменение структуры молекулы фенолфталеина, что приводит к изменению ее цвета с красного на бесцветный.
Катализаторы реакции обесцвечивания фенолфталеина могут быть использованы в реакциях окисления, нейтрализации и других процессах, где требуется изменение цвета показателей для определения степени протекания реакции или концентрации присутствующих веществ.
Закономерности явления

Фенолфталеин - это сложное органическое соединение, которое в чистом виде имеет красную окраску. Он обладает способностью менять свой цвет в зависимости от pH-среды, в которой он находится.
При взаимодействии фенолфталеина с кислотами, он приобретает кислотно-красный цвет. Однако, при реакции с щелочами фенолфталеин обесцвечивается.
Это происходит из-за того, что щелочи приводят к депротонированию молекул фенолфталеина. В кислой среде молекула фенолфталеина находится в протонированном состоянии, а в щелочной среде она депротонируется и принимает нейтральное состояние.
Когда молекула фенолфталеина депротонируется, происходит смена ее конформации, что приводит к изменению соединений между атомами и дальнейшему обесцвечиванию.
Таким образом, закономерности обесцвечивания фенолфталеина при реакции связаны с депротонированием молекулы под влиянием щелочей, что приводит к изменению ее конформации и потере красного цвета.



