Атомы - это основные строительные блоки всех веществ в нашей Вселенной. Они состоят из протонов, нейтронов и электронов, которые вращаются вокруг ядра. Однако, почему электроны, двигаясь со значительными скоростями, не испускают энергию и не падают на ядро? В этой статье мы рассмотрим причины, по которым электроны не излучают энергию и сохраняют свои орбиты.
Основной физический принцип, объясняющий этот феномен, называется квантовой механикой. По квантовой механике, электроны в атомах могут находиться только на определенных энергетических уровнях, и эти уровни имеют определенные значения энергии. Таким образом, электрон в атоме не может находиться на произвольном расстоянии от ядра или иметь произвольную энергию.
Важно отметить, что когда электрон в атоме переходит с одного энергетического уровня на другой, он испускает или поглощает энергию в виде фотонов света или других электромагнитных волн. Это явление известно как спектральные линии и очень важно для анализа состава вещества через спектроскопию. Однако, когда электрон находится на определенном энергетическом уровне, он не испускает энергию и продолжает двигаться по своей орбите.
Внешний планетарный эффект

Как мы знаем, электрон, находящийся в атоме, движется по определенной орбите вокруг ядра. Согласно классической электродинамике, электрон, испытывая ускорение при движении, должен излучать электромагнитные волны. Поэтому можно было бы ожидать, что электрон, движущийся вокруг ядра, потеряет энергию и, в результате, упадет на ядро.
Однако, согласно квантовой механике, электрон может находиться только на определенных энергетических уровнях, или орбитах, и не может совершать непрерывное движение. Вот где возникает внешний планетарный эффект.
Согласно квантовой механике, электрон находится в состоянии с фиксированной энергией и не испытывает ускорения при движении. Это означает, что электрон не излучает энергию и не падает на ядро. Вместо этого, электрон остается на своей орбите и переходит только на другие энергетические уровни, когда поглощает или излучает квант энергии.
Таким образом, внешний планетарный эффект является результатом квантовых свойств электрона, которые позволяют ему находиться на определенных орбитах и не излучать энергию, сохраняя стабильность атома.
Орбитальная движущаяся энергия

Электрон в атоме обладает орбитальной движущейся энергией, которая позволяет ему находиться в стабильном состоянии на своей орбите. Этот феномен объясняется квантовой механикой и основными принципами электронной структуры атома.
Орбитальная движущаяся энергия электрона связана с его скоростью и массой. Согласно принципу неопределенности Гейзенберга, точная позиция и скорость электрона не могут быть одновременно известны. Таким образом, электрон находится в состоянии суперпозиции, где он распределен по орбитали с определенной энергией.
В то время как орбитальная движущаяся энергия электрона может изменяться в зависимости от его состояния, существуют определенные разрешенные энергетические уровни, которые электрон может занимать. Эти уровни образуют энергетическую лестницу, называемую энергетической структурой атома.
| Энергетический уровень | Описание |
|---|---|
| Основной уровень | Самый низкий энергетический уровень, на котором находится электрон. Здесь электрон наиболее стабилен. |
| Возбужденные уровни | Уровни, на которые электрон может перейти при поглощении энергии. Электрон может затем вернуться на основной уровень, излучив лишнюю энергию в виде фотона. |
| Континуальные уровни | Уровни, которые не являются дискретными и описывают электроны, находящиеся в состоянии, близком к ионизации. |
Таким образом, электрон в атоме не излучает энергию непрерывно, а только при переходе между энергетическими уровнями. Этот феномен объясняет стабильность атома и его способность к поглощению и излучению света.
Взаимодействие электрона с ядром

Основными составляющими взаимодействия являются электростатическая сила и сила тяжести. Электростатическая сила притяжения, действующая между электроном и ядром, основана на законе Кулона и пропорциональна произведению зарядов и обратно пропорциональна квадрату расстояния между ними.
В результате этого взаимодействия электрон испытывает центростремительное ускорение, направленное к ядру. Однако, в соответствии с принципом сохранения энергии, электрон не излучает энергию и не падает на ядро.
При движении электрона вокруг ядра возникает так называемая квантовая структура энергетических уровней, которая описывает разрешенные энергетические состояния электрона в атоме. Этот факт позволяет электрону оставаться в стабильном состоянии и не излучать энергию в виде электромагнитного излучения.
| Факторы влияния на электрон | Влияние на электрон |
|---|---|
| Заряд ядра | Определяет силу притяжения и энергетические уровни электрона |
| Расстояние до ядра | Определяет силу притяжения и энергетические уровни электрона |
| Масса ядра | Оказывает влияние на ядерные реакции и стабильность атома |
Законы сохранения энергии

Существует несколько законов сохранения энергии, которые объясняют, почему электрон в атоме не излучает энергию:
- Закон сохранения энергии. Согласно этому закону, энергия в системе остается постоянной, она может только превращаться из одной формы в другую. В случае электрона в атоме, энергии электрона достаточно, чтобы он мог двигаться по орбите вокруг ядра атома без излучения энергии.
- Закон сохранения момента импульса. Момент импульса является фундаментальной характеристикой движения. Согласно закону сохранения момента импульса, момент импульса системы остается постоянным, если система не подвергается внешним воздействиям. Таким образом, излучение энергии электроном привело бы к изменению его момента импульса, что противоречит закону сохранения момента импульса.
- Закон сохранения электрического заряда. Закон сохранения электрического заряда гласит, что сумма зарядов в изолированной системе остается постоянной. Электрон в атоме имеет отрицательный заряд, и его излучение энергии вызвало бы изменение его заряда, что противоречит закону сохранения электрического заряда.
Таким образом, законы сохранения энергии, момента импульса и электрического заряда объясняют, почему электрон в атоме не излучает энергию. Электрон сохраняет свою энергию, момент импульса и заряд на постоянном уровне благодаря этим законам.
Квантовая механика

Одним из основных результатов квантовой механики является понятие энергетических уровней частиц. В атоме, электроны занимают определенные энергетические уровни, которые определяются их энергией и моментом импульса. Каждый энергетический уровень соответствует определенному излучению энергии или частоте света. Если электрон переходит с одного энергетического уровня на другой, он может излучить или поглотить энергию в виде фотонов света.
Однако, вместо того чтобы постоянно излучать энергию и терять свою кинетическую энергию, электроны находятся в стационарных состояниях, где их энергия остается постоянной и они не излучают энергию. Этот эффект объясняется волновой природой электронов и возможностью их существования только на определенных энергетических уровнях, которые представляют собой дискретные значения энергии. Таким образом, электрон не теряет энергию и остается на своем энергетическом уровне до тех пор, пока не произойдет воздействие внешнего фактора, способного возбудить его и вызвать переход на более высокий или нижний энергетический уровень.
Принцип неопределенности Хайзенберга
Принцип неопределенности или принцип неопределенности Хайзенберга, разработанный в 1927 году немецким физиком Вернером Хайзенбергом, играет важную роль в квантовой механике. Он утверждает, что существует фундаментальное ограничение на точность, с которой одновременно можно измерить некоторые пары физических величин, таких как координата и импульс, энергия и время.
Согласно принципу неопределенности, невозможно точно измерить положение и скорость движения электрона в атоме одновременно. Это означает, что электрон не имеет четко определенной орбиты или траектории вокруг ядра атома. Вместо этого, его положение и скорость могут быть только вероятностно определены.
Принцип неопределенности Хайзенберга имеет глубокое физическое обоснование и связан с волновыми свойствами частиц. Согласно квантовой механике, электрон в атоме представляет собой частицу и волну одновременно. Измерение одной физической величины, например, положения электрона, влечет за собой неизбежное воздействие на его волновую функцию, что приводит к неопределенности в других физических величинах, например, в его скорости или импульсе.
| Принцип | Неопределенности |
| Физик | Вернер Хайзенберг |
| Год | 1927 |
| Фундаментальное ограничение | точность измерения некоторых пар физических величин |
| Пример величин | координата и импульс, энергия и время |
Принцип неопределенности Хайзенберга имеет важные последствия для понимания и описания микромира. Он объясняет, почему электрон в атоме не излучает энергию, как это происходит в классической физике. Вместо того чтобы двигаться по орбите с постоянной скоростью, электрон находится в состоянии "неразрывно" связанной энергии вокруг ядра атома.
Принцип неопределенности Хайзенберга является одним из основных принципов квантовой механики и его невозможно обойти или преодолеть. Он помогает нам понять и принять недетерминистическую и вероятностную природу микромира и имеет широкие применения в различных областях физики и науки в целом.
Энергетические состояния электрона
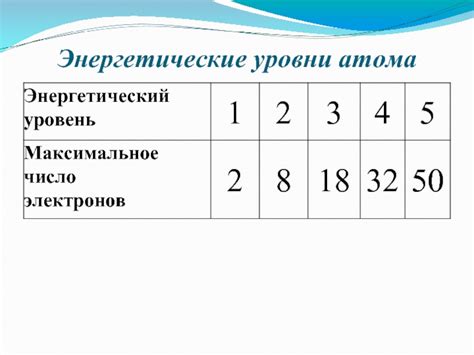
В атоме электрон находится в определенных энергетических состояниях, которые называются орбиталями или энергетическими уровнями. Эти состояния определяются квантовым уровнем энергии, на котором находится электрон.
Наиболее низким энергетическим состоянием является основное состояние атома, обозначаемое как n=1. Состояние n=2 имеет более высокую энергию, состояние n=3 - еще более высокую и так далее. Каждый энергетический уровень может вместить определенное количество электронов, и это количество определяется по правилу Клейна-Гордона.
Электрон может переходить между различными энергетическими состояниями, испуская или поглощая энергию в виде фотонов. Однако, если электрон находится на стабильном энергетическом уровне, то он не излучает энергию. Это происходит из-за того, что электрон находится в стационарном состоянии, которое длительное время не меняется.
Такое стационарное состояние возникает из-за согласования между энергией электрона и энергией ядра, так называемое "правило рассогласования": электрон должен находиться на уровне энергии, на котором разность между энергией ядра и электрона минимальна. Это позволяет электрону находиться в устойчивом состоянии и не излучать энергию.
Электромагнитное излучение
При движении электрически заряженных частиц, таких как электроны в атомах, возникают изменяющиеся электрические и магнитные поля. Именно эти изменяющиеся поля и создают электромагнитное излучение.
В атоме электрон вокруг ядра движется на определенных энергетических уровнях. Когда электрон переходит с более высокого энергетического уровня на более низкий, он излучает энергию в виде электромагнитного излучения. Это происходит, например, при испускании света флуоресцентными лампами или при воспламенении пламени свечи.
Однако, если электрон находится на своем низшем энергетическом уровне, то он не может перейти на еще более низкий уровень и, следовательно, не будет излучать энергию. Это объясняет, почему электрон в атоме не излучает энергию постоянно, а только при переходе на более низкий уровень энергии.
Таким образом, электромагнитное излучение в атоме является результатом перехода электрона с одного энергетического уровня на другой. Этот процесс может происходить ограниченное количество раз, и каждый переход соответствует определенной энергии излучения.
Важно отметить, что электроны в атоме не излучают энергию спонтанно. Они передают энергию в виде излучения только при переходе с высокого энергетического уровня на низкий. Это явление известно как дискретное излучение энергии и играет ключевую роль в различных физических и химических процессах.
Стабильность атома

Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов, движущихся по орбитам вокруг ядра. Однако, согласно классическим представлениям физики, электрон, двигаясь по орбите, должен испытывать ускорение и, соответственно, излучать энергию. Таким образом, атом должен неизбежно терять энергию и становиться неустойчивым.
Однако, на практике атомы оказываются стабильными. Это объясняется введением квантовой механики, которая описывает поведение электронов в атоме. Квантовая механика утверждает, что электрон не движется по конкретной орбите, как это было представлено раньше, а находится в определенных энергетических состояниях, называемых квантовыми уровнями. Каждый квантовый уровень соответствует определенной энергии.
Переход электрона с одного квантового уровня на другой происходит при поглощении или испускании фотона, частицы света. При этом электрон переходит на уровень с меньшей энергией, что означает, что энергия системы остается постоянной. Это позволяет атому сохранять стабильность, так как электрон не теряет энергию при движении вокруг ядра.
Таким образом, стабильность атома обеспечивается квантовой механикой, которая описывает поведение электронов и энергетические состояния атома. При переходе электрона на более низкий энергетический уровень энергия системы сохраняется, что позволяет атому оставаться стабильным и не терять энергию.
| Источники: | 1. Левшиц А. И., Ситарников В. А. Физика. 10-11 классы. - М. Дрофа, 2013. | 2. Фейнман Р. Фейнмановские лекции по физике. Т. 3. Квантовая механика. - М. Янус-М, 2009. |
Квантовый запрет на излучение энергии
Согласно классической физике, заряженная частица, испытывающая ускорение, должна излучать энергию в виде электромагнитных волн. Однако, квантовая механика показывает, что электрон в атоме находится в так называемом стационарном состоянии, при котором его энергия имеет фиксированное значение и не меняется со временем. Это означает, что электрон не может испытывать ускорение и, следовательно, не излучает энергию.
Квантовый запрет на излучение энергии объясняется свойствами волновой функции электрона, которая описывает его состояние в атоме. Волновая функция имеет определенные значения для энергии электрона, и только эти значения являются разрешенными. Если электрон переходит из одного разрешенного состояния в другое, то это сопровождается излучением или поглощением энергии. Однако, сам по себе электрон находится в стационарном состоянии и не может менять свою энергию без изменения внешних условий.
Квантовый запрет на излучение энергии имеет фундаментальное значение для понимания поведения электронов в атоме и является одной из основных причин существования стабильных атомных структур. Благодаря этому свойству электроны могут образовывать атомные оболочки с определенным числом энергетических уровней, что определяет химические свойства элементов и возможность образования химических связей.



