Благородные газы – это группа элементов, отличающихся особыми химическими свойствами. Они принадлежат к 8 группе периодической таблицы Менделеева и состоят из гелия, неона, аргона, криптона, ксенона и радона. Несмотря на свою низкую реактивность, благородные газы играют важную роль в различных сферах нашей жизни.
Причина своеобразия благородных газов заключается в их электронной конфигурации. Внешний электронный уровень благородных газов полностью заполнен, что делает их наиболее стабильными из всех элементов. Эта особенность приводит к тому, что благородные газы практически не проявляют химическую активность и не вступают в реакции с другими веществами.
Эта устойчивость делает благородные газы очень полезными во многих областях. Например, гелий широко используется в аэростатике благодаря своей низкой плотности и нереактивности. Неон применяется в неоновых вывесках, а его светящиеся свойства наделяют различные объекты яркими оттенками. Аргон используется в заполнении ламп и создании защитных атмосфер для сварки. Криптон, ксенон и радон находят применение в светотехнике, медицине и научных исследованиях.
Определение благородных газов и их свойство почему они были отнесены к 8 группе

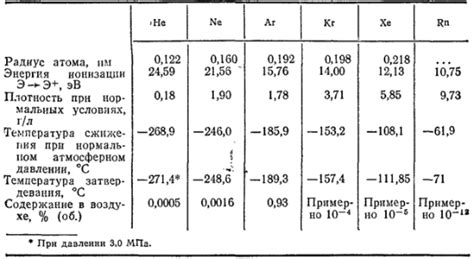
Основными представителями благородных газов являются гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn). Они характеризуются высокой стабильностью и инертностью, то есть не участвуют в химических реакциях и практически не образуют соединений с другими элементами.
Первоначально, благородные газы были отнесены к 8 группе периодической системы элементов из-за сходства своих электронных оболочек. У всех благородных газов на внешнем энергетическом уровне находятся 8 электронов, что соответствует заполненной s- и p-подоболочкам. Это делает эти элементы стабильными и малоактивными.
Благородные газы обладают также низкой плотностью, малой теплопроводностью и плохо реагируют с активными веществами. Такие свойства делают их полезными в различных областях науки и техники. Например, благородный газ гелий используется в заполнении аэростатов из-за своей низкой плотности, аргон применяется при сварке для защиты от окисления и др.
- Свойства благородных газов:
- Высокая стабильность и инертность
- Низкая плотность
- Малая теплопроводность
- Плохая реакционная способность
Именно из-за этих особенностей благородные газы были отнесены к 8 группе периодической системы элементов. Они образуют особый класс веществ, которые играют важную роль в науке и промышленности, их уникальные свойства позволяют использовать их в различных сферах деятельности человека.
Химический состав благородных газов и их реактивность

Благородные газы, также известные как инертные газы, включают группу элементов, которые обладают особенными химическими свойствами. В 8 группе периодической системы расположены шесть благородных газов: гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn).
Химический состав:
Благородные газы являются моноатомными элементами и находятся в группе нулевой валентности. Они обладают полностью заполненной внешней электронной оболочкой, что делает их стабильными и малореактивными. Внешняя электронная оболочка благородных газов имеет восемь электронов, кроме гелия, у которого их всего два.
Реактивность:
Благородные газы известны своей низкой реактивностью, так как их внешняя электронная оболочка уже полностью заполнена электронами. Они практически не реагируют с другими элементами и химическими соединениями. Именно это отношение благородных газов к реактивности и делает их "благородными".
Однако, несмотря на свою малореактивность, благородные газы имеют ряд примечательных применений в различных областях науки и промышленности. Например, гелий применяется в аэрозолях для охлаждения и использования в докторских исследованиях, а аргон используется для создания инертной атмосферы в сварке и лазерных резках.
Благородные газы обладают особенным химическим составом и высокой степенью стабильности, что делает их малореактивными и неподвижными. Их низкая реактивность является результатом полной заполненности внешней электронной оболочки. В то же время, благородные газы играют важную роль в различных областях науки и промышленности, благодаря своим особым свойствам и применениям.
Внешние свойства благородных газов и их значение в промышленности
Одним из наиболее заметных внешних свойств благородных газов является их бесцветность и беспахучесть. Это делает их незаметными и безопасными для использования, поскольку их наличие не может быть обнаружено непосредственно человеком. Кроме того, благородные газы обладают высокой степенью инертности, что означает, что они не реагируют с другими веществами и не поддерживают горение, что делает их безопасными для использования в различных промышленных процессах.
Благодаря своим уникальным свойствам, благородные газы находят широкое применение в различных отраслях промышленности. Например, гелий широко используется в аэрозолях и газовых смесях для заправки шаров и пластиковых пузырей. Аргоны применяются в сварочных работах, так как они обеспечивают правильные условия для получения качественных сварных соединений. Криптон используется в светотехнике, в частности, в лазерах и осветительных приборах.Ксенон применяется в электрических лампах и в фотографии.
Таким образом, благородные газы имеют важное значение в промышленности благодаря своим уникальным свойствам, которые позволяют им быть безопасными и эффективными в использовании. Их широкий спектр применения в различных отраслях является подтверждением их ценности и значимости.
История отнесения благородных газов к 8 группе и ее эволюция

Отнесение благородных газов к 8 группе таблицы Менделеева имеет свою историю, которая начинается еще в XIX веке. Само понятие "благородные газы" было введено ученым Фридрихом Адольфом Приклем в 1881 году. Он назвал их "благородными" в силу их высокой инертности и неактивности.
На ранней стадии развития химии благородные газы считались элементами группы VIIB, однако позднее они были перенесены в группу VIIIB. Причиной такого переноса была неоднозначность свойств благородных газов и их взаимодействий с другими элементами.
Значительный прорыв в понимании химических свойств благородных газов произошел в XX веке. Экспериментальные исследования, проведенные Лимбургом и американскими химиками Майером и Андрии, показали, что благородные газы обладают уникальными свойствами, отличающимися от других элементов таблицы Менделеева.
В настоящее время благородные газы относятся к 8 группе таблицы Менделеева, которая также называется группой инертных газов. Это связано с их химической инертностью и слабой реакционной способностью, что делает их особенно ценными в различных областях науки и промышленности.
Применение благородных газов в науке и медицине

Благородные газы, такие как гелий, неон, аргон, криптон и ксенон, обладают рядом уникальных свойств, благодаря чему они нашли широкое применение в различных сферах науки и медицины.
В научных исследованиях благородные газы используются для создания контролируемых условий, так как они обладают низкими точками кипения и плотностью. Например, гелий применяется в экспериментах с низкими температурами, аргон и криптон - для создания защитной среды от воздействия окружающей среды на материалы и оборудование.
Благородные газы также применяются в медицине, особенно в области хирургии и диагностики. Например, ксенон используется в анестезиологии, благодаря своим анестезирующим свойствам. Он безопасен и имеет меньшую токсичность, чем другие анестезирующие газы. Кроме того, благородные газы, такие как аргон и криптон, применяются в лазерной хирургии для коагуляции кровеносных сосудов и удаления опухолей. Они позволяют точно дозировать энергию и минимизировать повреждения окружающих тканей.
Медицинское применение благородных газов также связано с их светоэмиссионными свойствами. Например, неон используется для создания лазеров, которые применяются в дерматологии и косметологии для удаления пигментных пятен и татуировок, а также в офтальмологии для коррекции зрения.
Таким образом, благородные газы являются важным инструментом в научных и медицинских исследованиях, обеспечивая контролируемые условия и предоставляя возможность для точной диагностики и лечения различных заболеваний. Их уникальные свойства делают их незаменимыми во многих областях, что обусловило их отнесение к 8 группе в таблице периодических элементов.
Факторы, влияющие на причисление благородных газов к 8 группе
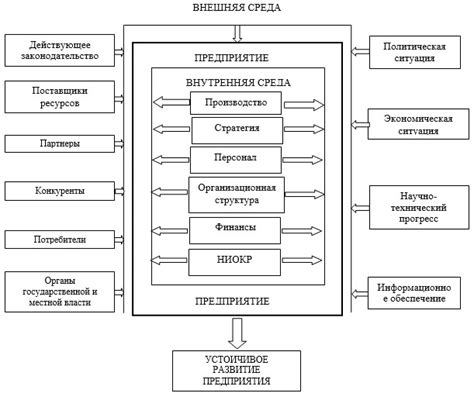
В таблице Менделеева химические элементы расположены в определенном порядке, и их свойства определяют их группу и период. Однако, почему благородные газы, такие как гелий, неон, аргон, криптон и ксенон, были отнесены к 8 группе, хотя их электронные конфигурации отличаются от других элементов этой группы? Существуют несколько факторов, которые объясняют это решение.
1. Электронная конфигурация
В электронной конфигурации благородных газов последний энергетический уровень заполнен полностью. Например, в случае аргона, электронная конфигурация будет 1s2 2s2 2p6 3s2 3p6, где последний энергетический уровень (3p) полностью заполнен. Это характерное свойство благородных газов отличает их от других элементов 8 группы и делает их неактивными и стабильными.
2. Периодические закономерности
Периодические закономерности в таблице Менделеева играют важную роль в причислении элементов к определенной группе. Благородные газы, в силу своей электронной конфигурации, имеют схожие свойства, такие как низкую реактивность и высокую стабильность. Поэтому они были отнесены к 8 группе, чтобы подчеркнуть их химическую инертность и аналогичность.
3. Групповые свойства
В таблице Менделеева группы элементов объединяются на основе их общих свойств. Благородные газы обладают сходством во многих аспектах, таких как плотность и точка кипения. Они также всегда находятся в газообразном состоянии при стандартных условиях. Такие групповые свойства укрепили их причисление к 8 группе вместе с другими элементами, хотя они не имеют последней заполненной энергетической оболочки, как другие элементы этой группы.
Объяснение выбора номера 8 для группы благородных газов

Группа благородных газов, также известных как инертные газы, состоит из элементов химического ряда, которые характеризуются особыми свойствами. Объединение этих элементов в одну группу имеет физическое и химическое обоснование, что объясняет их позицию в 8 группе периодической системы элементов.
Причина, по которой благородные газы находятся в 8 группе, связана с их электронной конфигурацией. Благородные газы имеют заполненную внешнюю электронную оболочку, состоящую из полного комплекта электронов. Такая конфигурация делает эти элементы стабильными и малоактивными, поэтому их сложно вовлечь в химические реакции.
Конкретно, благородные газы имеют 8 электронов в своей внешней электронной оболочке, за исключением гелия, который имеет заполненную внешнюю оболочку из 2 электронов. Такая электронная конфигурация согласуется с общей схемой периодической системы элементов, где по горизонтали принято считать количество электронов в электронных оболочках элемента.
Таким образом, благородные газы занимают 8 группу периодической системы элементов, чтобы подчеркнуть их сходство в электронной конфигурации и отличие от других элементов с различными электронными оболочками. Это упрощает изучение и систематизацию элементов в ряду, и помогает лучше понять их химические и физические свойства.
Важность понимания свойств благородных газов для химиков и физиков

Благородные газы, такие как гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn), относятся к 8 группе периодической таблицы элементов. Они обладают рядом уникальных свойств, которые делают их важными для химиков и физиков.
Во-первых, благородные газы обладают высокой инертностью, то есть мало вступают в химические реакции с другими веществами. Это свойство делает их идеальными для использования в различных процессах, где требуется отсутствие реакций или нежелательны химические изменения. Например, благородные газы используются в электрических лампах, лазерах, накопителях энергии, воздушных шарах и т.д.
Кроме инертности, благородные газы обладают уникальной способностью поглощать и излучать свет. Это эффект называется флюоресценцией. Некоторые благородные газы, например, неон и аргон, используются для создания разноцветных неоновых и газоразрядных ламп, которые находят применение в рекламе, искусстве и декоративном освещении.
Однако, несмотря на их полезность в различных областях, благородные газы являются редкими и дорогостоящими. Они не являются обильно распространенными на Земле и, в большинстве случаев, добываются из воздуха или землесодержащих руд. Поэтому их потреблять необходимо с осторожностью, экономно и эффективно использовать в различных технологиях.
Сравнение благородных газов с другими элементами периодической таблицы

Благородные газы, также известные как инертные газы, относятся к 8 группе периодической таблицы. Они состоят из следующих элементов: гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn). В отличие от других групп элементов, благородные газы обладают уникальными свойствами, которые делают их особенными и выделяют их среди остальных элементов.
Одной из главных особенностей благородных газов является их высокая химическая инертность. Это означает, что они практически не вступают в химические реакции с другими элементами. Они являются стабильными и не образуют химических связей с другими атомами. Благодаря этому свойству, инертные газы широко используются в различных отраслях, таких как сварка, лазерная техника, приборостроение и промышленность. Они также используются в заполнении ламп накаливания, лазеров, газоразрядных трубок и других электронных устройств.
В отличие от благородных газов, другие элементы периодической таблицы образуют химические соединения и взаимодействуют с другими атомами. Например, элементы из первой группы, такие как литий (Li), натрий (Na) и калий (K), реагируют с водой, образуя щелочные гидроксиды и выделяя водород. Они также образуют ионы, вступают в реакции окисления и образуют соединения с другими элементами.
Благородные газы также отличаются от элементов других групп периодической таблицы по своим физическим свойствам. Они имеют очень низкие температуры кипения и плавления, что делает их газами при комнатной температуре и давлении. Они также обладают высокой плотностью, низкой растворимостью и отсутствием окраски. Благодаря этим свойствам, они широко используются в научных исследованиях, при разработке новых материалов и в технических процессах, требующих контролируемой атмосферы.
Таким образом, благородные газы обладают уникальными химическими и физическими свойствами, которые делают их особенными среди других элементов периодической таблицы. Их инертность и стабильность позволяют им находить широкое применение в различных областях, а их физические свойства делают их незаменимыми инструментами в различных технических исследованиях и процессах.
```html
Перспективы использования благородных газов в будущих технологиях

Благородные газы, такие как гелий, неон, аргон, криптон и ксенон, всегда привлекали внимание ученых своими уникальными свойствами. Сегодня данные газы широко используются в различных областях, включая научные и медицинские исследования, световые технологии, электронику и промышленность. Однако перспективы использования благородных газов в будущих технологиях выходят далеко за рамки текущих областей применения.
Первая перспектива заключается в использовании благородных газов в нанотехнологиях. Благодаря своей низкой химической реактивности и стабильности, благородные газы могут быть использованы для создания наноструктур и нанодевайсов с оптимальными свойствами. Это открывает возможности для создания новых материалов, устройств и систем с высокой производительностью и уникальными функциями.
Еще одна перспектива связана с использованием благородных газов в геологии и энергетике. Благодаря своей инертности и стабильности, эти газы могут использоваться в процессах добычи нефти и газа, а также в хранении и транспортировке водорода, который сегодня рассматривается как энергетический носитель будущего. Кроме того, благородные газы могут быть использованы в ядерной энергетике, в частности, в процессе охлаждения реакторов.
Также стоит отметить перспективы использования благородных газов в экологии и защите окружающей среды. Благородные газы могут быть использованы в процессе очистки и фильтрации воздуха, удаления вредных веществ и озона из атмосферы. Кроме того, благородные газы могут использоваться в процессе очистки воды и снижения загрязнения окружающей среды.



