Атомы - основные строительные блоки материи, из которых состоят все вещества во Вселенной. Они обладают сложной структурой, включающей ядро и облако электронов, и постоянно взаимодействуют друг с другом. Одним из ключевых аспектов этого взаимодействия является стремление атомов к завершению внешнего электронного слоя, то есть к наличию полного комплекта внешних электронов.
Внешний электронный слой атома определяет его химические свойства и способность образовывать химические связи с другими атомами. Этот слой может содержать до 8 электронов, кроме некоторых исключений. Атомы стремятся к завершению внешнего электронного слоя, поскольку это состояние обеспечивает им наибольшую энергетическую стабильность.
Когда атом имеет неполный внешний электронный слой, он становится нестабильным и стремится установить химические связи с другими атомами, чтобы заполнить отсутствующие электроны. Это происходит путем обмена, передачи или совместного использования электронов с другими атомами. Через такие химические связи атомы образуют молекулы и структуры, которые обладают более высокой стабильностью и более низкой энергетической потенциальной энергией. Поэтому атомы постоянно стремятся к завершению внешнего электронного слоя, чтобы достичь более устойчивого состояния.
Почему атомы стремятся

Атомы стремятся к завершению внешнего электронного слоя по принципу полной заполненности. Это связано с достижением более стабильного и энергетически выгодного состояния.
Внешний электронный слой атома содержит валентные электроны, которые принимают участие в химических реакциях и связях между атомами. Полностью заполнив внешний слой, атом достигает электронной конфигурации инертного газа, что обеспечивает ему максимальную стабильность.
Кроме того, при полной заполненности внешнего слоя у атома устанавливается электронейтральность, то есть равное количество положительных и отрицательных зарядов, что делает его более устойчивым.
Стремление атомов к завершению внешнего электронного слоя определяет их химическую активность. Не заполненный внешний слой приводит к возможности образования связей с другими атому и молекулами для достижения стабильности. Это основа химических реакций и процессов, таких как образование соединений и реакции окисления-восстановления.
Завершение внешнего электронного слоя
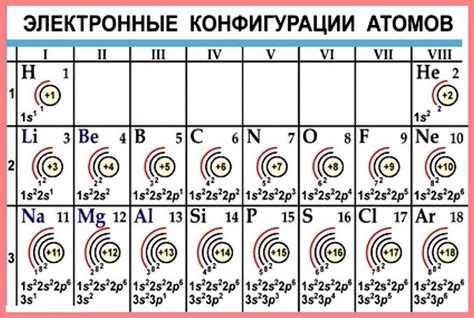
Атомы стремятся к завершению внешнего электронного слоя, так как это позволяет им достичь более устойчивого энергетического состояния. Внешний электронный слой, или валентная оболочка, содержит электроны, которые участвуют в химических реакциях и образовании химических связей.
Когда атом имеет полностью заполненный внешний электронный слой, он обладает наиболее низкой энергией и наибольшей стабильностью. Это объясняется тем, что когда внешний электронный слой полностью заполнен, электроны образуют пары и становятся параллельно распределенными. Такое распределение электронов минимизирует их отталкивающее взаимодействие и создает более устойчивую конфигурацию.
Атомы стремятся достичь завершенности внешнего электронного слоя путем формирования химических связей или принятия/отдачи электронов. Например, химические элементы из группы 1 (щелочные металлы) имеют один валентный электрон во внешнем слое и легко отдают его, чтобы достичь электронной конфигурации инертного газа. Элементы из группы 17 (галогены) имеют семь валентных электронов и легко принимают один электрон от другого атома, чтобы также достичь электронной конфигурации инертного газа.
Достижение завершенности внешнего электронного слоя является ключевым фактором в формировании химических соединений и образовании различных типов связей. Завершение внешнего электронного слоя приводит к более стабильным и менее реактивным атомам, что имеет важное значение для различных химических процессов и свойств вещества.
Причины атомов стремиться
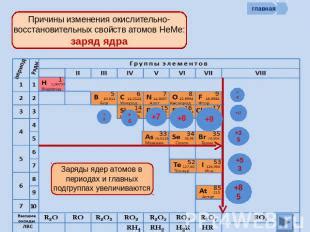
1. Обеспечение стабильности
Атомы стремятся к завершению своего внешнего электронного слоя, чтобы достичь максимальной стабильности. Внешний электронный слой, или валентная оболочка, играет ключевую роль в химических реакциях и формировании химических связей. Завершенный внешний слой позволяет атому быть электронно стабильным и уменьшает его склонность к реакциям.
2. Достижение октетного правила
Многие атомы стремятся к завершению внешнего электронного слоя, чтобы достичь октетного правила. Октетное правило гласит, что атомы имеют наибольшую энергетическую стабильность, когда их внешний электронный слой содержит 8 электронов. С таким внешним слоем атом становится электронно неактивным и имеет аналогию с наиболее стабильным газовым состоянием - инертными газами из группы благородных газов.
3. Формирование химических связей
Завершенный внешний электронный слой позволяет атому образовывать химические связи с другими атомами, чтобы стать электронно стабильным. Атомы могут обменивать, принимать или делить свои внешние электроны с другими атомами, чтобы образовать стабильные молекулы. Это образование химических связей позволяет атомам достичь максимально энергетически выгодного состояния.
4. Увеличение энергетической устойчивости
Атомы стремятся к завершению внешнего электронного слоя для увеличения своей энергетической устойчивости. Завершенный внешний слой позволяет атому минимизировать свою энергетическую нестабильность и уменьшить энергию, необходимую для образования и поддержания связи с другими атомами. Это свойство является ключевым фактором в многих химических реакциях и процессах.
К завершению электронного слоя
Атомы стремятся к завершению внешнего электронного слоя из-за своей строения и устремления к более устойчивому состоянию. Внешний электронный слой или валентная оболочка играет ключевую роль в химической активности атома.
Валентная оболочка содержит валентные электроны, которые могут участвовать в химических реакциях и связывании с другими атомами. Атомы, стремясь к завершению внешнего электронного слоя, пытаются заполнить этот слой и достичь электронной конфигурации, аналогичной устойчивым инертным газам, таким как гелий, неон или аргон.
Завершение внешнего электронного слоя приводит к достижению более устойчивого и энергетически выгодного состояния атома. Это может быть достигнуто через принятие или отдачу электронов в химической реакции, образуя химические связи или обмениваясь электронами с другими атомами.
Стремление атомов к завершению внешнего электронного слоя является основным фактором, определяющим химическую активность элементов и возможность образования химических соединений. В химических реакциях атомы переносят или приобретают электроны с целью достижения более устойчивого электронного состояния.
Таким образом, завершение внешнего электронного слоя является ключевым для химической активности и связывания атомов, и определяет их химические свойства и поведение.
Баланс электрических зарядов
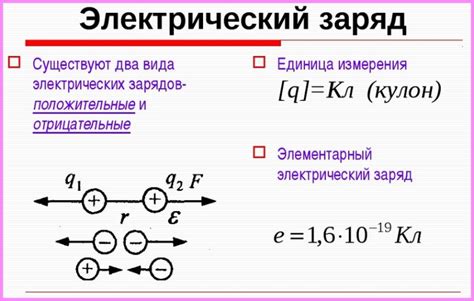
Атомы стремятся к завершению внешнего электронного слоя, так как это помогает им достичь баланса электрических зарядов.
Каждый элемент имеет определенное количество электронов, протонов и нейтронов. Протоны имеют положительный заряд, электроны - отрицательный, а нейтроны не имеют заряда.
У атома должно быть равное количество положительных и отрицательных зарядов, чтобы обеспечить его стабильность. Если количество электронов не соответствует количеству протонов, то атом будет иметь электрический заряд.
Незавершенные внешние электронные слои делают атомы нестабильными, поэтому они стремятся завершить эти слои, чтобы достичь более устойчивого состояния. Это осуществляется путем обмена, деления или захвата электронов, чтобы достичь полного или пустого внешнего слоя.
| Заряд | Электроны | Протоны | Нейтроны |
|---|---|---|---|
| Положительный | Меньше, чем протоны | Больше, чем электроны | Больше, чем электроны |
| Отрицательный | Больше, чем протоны | Меньше, чем электроны | Больше, чем электроны |
В результате завершения внешнего электронного слоя, атом достигает нейтрального заряда и становится более устойчивым. Это обеспечивает стабильность элементов и формирование химических связей в химических соединениях.
И атомное строение
Основная причина, по которой атомы стремятся завершить внешний электронный слой, связана с достижением более стабильного и энергетически выгодного состояния. Внешний электронный слой, также называемый валентным слоем, имеет наибольшую энергию и определяет химические свойства атома.
Атомы стремятся завершить внешний электронный слой путем образования химических связей с другими атомами. Это могут быть связи ионные, ковалентные или металлические. Цель атомов заключается в достижении электронной конфигурации, аналогичной электронной конфигурации октета - содержащей 8 электронов на внешнем электронном слое.
Процесс образования связей между атомами позволяет атомам достичь более стабильной энергетической конфигурации и тем самым повысить свою устойчивость. Это основа для образования различных соединений и веществ, которые обладают разнообразными свойствами и способностию взаимодействовать с окружающими средами.
Завершение внешнего электронного слоя является ключевым фактором в химических реакциях и определяет поведение атомов при взаимодействии с другими атомами. Оно обеспечивает атому более стабильное и устойчивое состояние, что влияет на его химические свойства и способность образовывать соединения.
Взаимодействие между атомами

Когда атом имеет неполный внешний электронный слой, он может вступать в химические реакции с другими атомами, чтобы достичь более устойчивого состояния. Это взаимодействие между атомами позволяет им образовывать химические связи и образовывать различные соединения.
Существуют различные типы взаимодействия между атомами в химических реакциях. Один из наиболее распространенных типов - обмен электронами. В этом процессе один атом отдает электроны, чтобы другой атом мог завершить свой внешний электронный слой. Это приводит к образованию ионов и образованию ионных связей.
Взаимодействие между атомами также может происходить путем обмена или совместного использования электронов. Это приводит к образованию ковалентных связей, где атомы обменивают пары электронов. Ковалентные связи могут быть одиночными, двойными или тройными, в зависимости от количества электронных пар, которыми они делятся.
Взаимодействие между атомами не только обеспечивает стабильность атомов, но и определяет их химические свойства. Различные элементы имеют разное количество электронов во внешнем электронном слое, что делает их реактивными или инертными. Все химические реакции основаны на взаимодействии между атомами и изменении их электронной конфигурации.
Таким образом, взаимодействие между атомами играет важную роль в химии, позволяя атомам образовывать химические связи и образовывать различные соединения. Это взаимодействие также определяет химические свойства элементов и их способность участвовать в реакциях.
Стабильность атомов и их завершенный внешний электронный слой
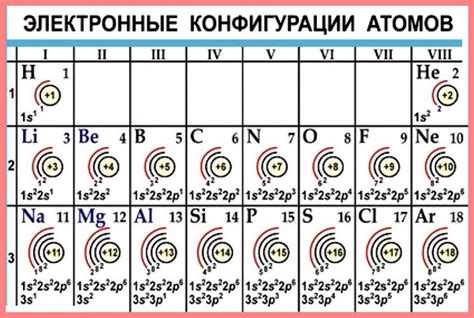
Стабильность атомов определяется их электронной конфигурацией, то есть расположением электронов в внутренних и внешних энергетических оболочках. Один из ключевых факторов, влияющих на стабильность атомов, это завершенность их внешнего электронного слоя.
Атомы стремятся к завершению внешнего электронного слоя, так как это состояние обеспечивает им наибольшую энергетическую стабильность. Внешний электронный слой атома называется валентным слоем и содержит электроны, которые участвуют в химических взаимодействиях между атомами.
У атомов, у которых внешний электронный слой имеет полностью заполненную оболочку, образуется особо стабильное состояние. Например, инертные газы, такие как неон (Ne), аргон (Ar) и криптон (Kr), имеют полностью заполненный внешний электронный слой и поэтому обладают высокой химической инертностью.
Атомы, стремясь к завершению валентного слоя, могут образовывать химические связи с другими атомами путем передачи, принятия или совместного использования электронов, чтобы достигнуть более стабильного состояния. Например, если атом натрия (Na) передает один из своих электронов атому хлора (Cl), то оба атома достигнут завершенности валентного слоя, образуя ионную связь и образуя стабильное соединение - хлорид натрия (NaCl).
Наличие завершенного внешнего электронного слоя обеспечивает атомам стабильность и снижает их склонность к химическим реакциям. Атомы, имеющие незавершенный внешний электронный слой, обладают большей энергией и большей реакционной способностью, что делает их более активными в химических реакциях.



