Атомы натрия и серы играют важную роль в химических реакциях и обладают разными свойствами, связанными с передачей и принятием электронов.
Натрий – это металл из группы щелочных металлов, а сера – неметалл из группы калькоидов. Металлы в процессе взаимодействия с неметаллами обычно отдают электроны, а неметаллы, наоборот, принимают электроны, чтобы достичь более стабильной электронной конфигурации.
В случае с атомом натрия, у него на внешнем энергетическом уровне находится один электрон. Из-за этого атом натрия имеет тенденцию избавиться от этого электрона. Это происходит в процессе образования ионов натрия, которые ионизуются путем отдачи одного электрона. Так атом натрия становится положительно заряженным ионом.
С другой стороны, атом серы имеет на внешнем энергетическом уровне шесть электронов. Такая конфигурация создает электронную нестабильность, и атом серы стремится принять два дополнительных электрона, чтобы достичь стабильной электронной конфигурации. В результате образуются ионы серы, которые при принятии электронов приобретают отрицательный заряд.
Таким образом, электроны могут быть переданы или приняты атомами в процессе образования ионов, чтобы достигнуть более стабильной электронной конфигурации. Атомы натрия отдают электроны, чтобы стать положительно заряженными, в то время как атомы серы принимают электроны, чтобы стать отрицательно заряженными. Это явление является результатом химической реакции и может быть объяснено разницей в электронной конфигурации и химических свойствах этих элементов.
Основные факторы, определяющие передачу электронов между атомами

Передача электронов между атомами обусловлена несколькими факторами, включая электроотрицательность элементов, энергию их электронных оболочек и размер атома.
Электроотрицательность элемента определяет его способность привлекать электроны в химической связи. Электроотрицательность натрия (Na) составляет 0,9, что является относительно низким значением. В то же время, электроотрицательность серы (S) составляет 2,58, что говорит о ее большей способности притягивать электроны.
Энергия электронных оболочек также играет роль в передаче электронов. Атом натрия имеет один электрон в своей последней оболочке, которая находится на большом расстоянии от ядра и имеет низкую энергию. Поэтому, атом натрия готов отдать этот электрон для образования ионной связи.
Атом серы, напротив, имеет шесть электронов в своей последней оболочке и стремится дополнить ее до восьми, чтобы достичь стабильной конфигурации октета. Поэтому, атом серы предпочитает принимать электроны от других атомов, чтобы образовать ион с отрицательным зарядом.
Размер атома также оказывает влияние на возможность передачи электронов. Чем меньше атом, тем легче отдать электрон, так как его притяжение к ядру сильнее. Атом натрия меньше по размеру, чем атом серы, поэтому он более склонен отдавать электрон.
Итак, основными факторами, определяющими передачу электронов между атомами, являются электроотрицательность элементов, энергия их электронных оболочек и размер атома. Эти факторы объясняют, почему атом натрия отдает электроны, а атом серы принимает их.
Размер атома натрия относительно размера атома серы
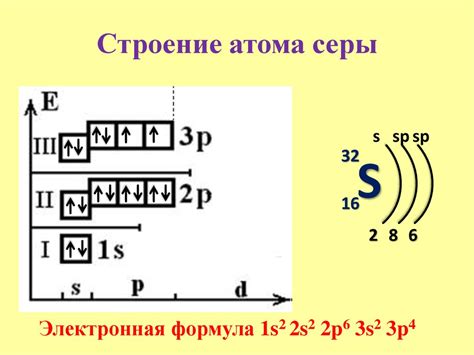
Размер атома напрямую связан с его электронной структурой и другими характеристиками элемента. Когда речь идет о размере атома, мы обычно говорим о его радиусе или диаметре.
Атом натрия обычно имеет больший размер, чем атом серы. Размер атома можно представить как сферу, и радиус атома натрия будет больше, чем радиус атома серы.
Различие в размере атомов натрия и серы объясняется их электронной конфигурацией и периодом в таблице элементов Менделеева. Натрий имеет электронную конфигурацию 2,8,1, что означает, что у него есть 3 электрона во внешней оболочке. Сера, с другой стороны, имеет электронную конфигурацию 2,8,6, что означает, что у нее есть 6 электронов во внешней оболочке.
Из-за разницы в количестве электронов во внешней оболочке атом натрия имеет меньший притягивающий эффект на электроны по сравнению с атомом серы. Это делает атом натрия склонным отдавать электроны, тогда как атом серы принимает электроны от других атомов.
Важно отметить, что размер атома также зависит от других факторов, таких как энергия облака электронов, валентность и электронная структура атома. Тем не менее, в случае натрия и серы, разница в электронной конфигурации является основным фактором, определяющим различие в их размерах.
| Элемент | Атомный радиус (нм) |
|---|---|
| Натрий | 0.186 |
| Сера | 0.104 |
Как видно из таблицы, атом натрия имеет больший размер, чем атом серы, что подтверждает наше утверждение о размерной разнице между этими двумя элементами.
Энергия ионизации атома натрия
Атом натрия, находясь в основном состоянии, имеет внешним электронным оболочкам один электрон на s-подуровне и одиннадцать электронов на p-подуровне. S-электронный уровень заполнен полностью, а p-электронный уровень заполнен одним электроном. Первым электроном, который может быть удален из атома натрия, является электрон с p-оболочки, так как на этой оболочке только один электрон.
В процессе ионизации атом натрия отдает этот электрон, чтобы достичь более стабильного состояния с полностью заполненными s- и p-электронными оболочками. Энергия, необходимая для удаления этого электрона из атома натрия, называется первой энергией ионизации. Для атома натрия первая энергия ионизации составляет около 496 кДж/моль.
Электроотрицательность атома натрия
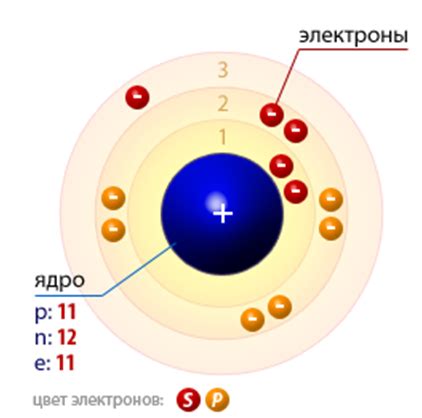
Атом натрия (Na) относится к щелочным металлам и имеет один электрон в внешней оболочке. У него довольно низкая электроотрицательность (0,93 по шкале Полинга), что свидетельствует о его большой склонности отдавать электрон и образовывать катион Na+.
В результате окислительно-восстановительных реакций атом натрия легко отдает свой единственный электрон, чтобы образовать ион с положительным зарядом. Это свойство делает натрий хорошим реагентом для получения осадков и образования ионов в растворах с другими элементами, такими как сера.
В отличие от натрия, атом серы (S) имеет шесть электронов во внешней оболочке и высокую электроотрицательность (2,58 по шкале Полинга). Это означает, что сера сильно притягивает электроны и образует отрицательно заряженные ионы (сульфиды).
Из-за разницы в электроотрицательности, атом серы имеет большую способность принимать электроны от атомов натрия в окислительных реакциях, что приводит к образованию стабильных химических связей и образованию ионов с отрицательными зарядами.
Энергия атома серы при приеме электронов
Когда атом серы принимает электроны, происходит процесс, известный как редокс-реакция. Во время этого процесса энергия атома серы изменяется и зависит от нескольких факторов.
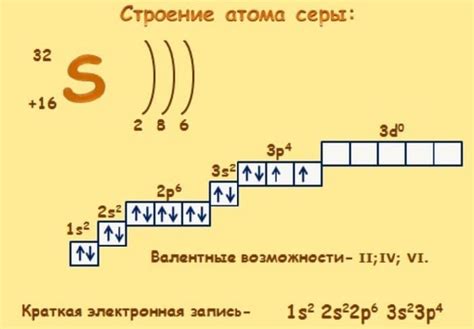
Прежде всего, энергетическое состояние атома серы определяется его электронной конфигурацией. Атом серы имеет 16 электронов, распределенных по электронным оболочкам. При приеме электрона атом серы становится отрицательно заряженным и его электронная конфигурация изменяется.
Другим фактором, влияющим на энергию атома серы при приеме электронов, является электрический заряд электрона, который принимается атомом серы. Электрон, имеющий отрицательный заряд, будет притягиваться к положительно заряженному атому серы. Силы притяжения зависят от расстояния между атомом серы и электроном, а также от зарядов обоих частиц.
Кроме того, энергия атома серы при приеме электронов зависит от энергетического состояния электронов в атоме. Атом серы имеет несколько энергетических уровней, на которых находятся его электроны. При приеме электрона, его энергия изменяется в соответствии с изменением энергетического состояния атома серы.
Информацию о энергии атома серы при приеме электронов можно представить в виде таблицы:
| Электронная конфигурация атома серы | Заряд электрона, принятого атомом серы | Изменение энергии атома серы при приеме электрона |
|---|---|---|
| 1s2 2s2 2p6 3s2 3p4 | -1 | Энергия атома серы увеличивается |
| 1s2 2s2 2p6 3s2 3p4 | -2 | Энергия атома серы увеличивается еще больше |
Таким образом, энергия атома серы при приеме электронов зависит от его электронной конфигурации, электрического заряда принимаемого электрона и энергетического состояния атома. Эти факторы определяют, какие электроны атом серы может принять и как изменится его энергия в результате редокс-реакции.
Ионизационный потенциал атома серы
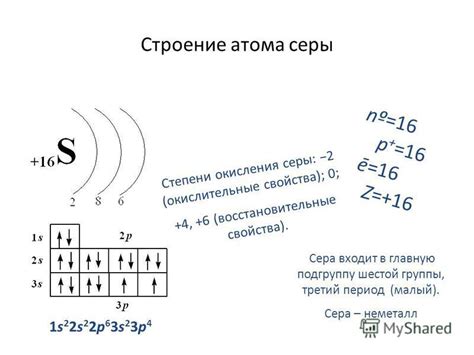
Это объясняется электронной конфигурацией атома серы, которая содержит 6 электронов в валентной оболочке. Валентная оболочка атома серы имеет возможность принять 2 дополнительных электрона, чтобы достичь стабильной конфигурации с полной валентной оболочкой, подобно атому аргон (Ar).
Поэтому, ионизационный потенциал атома серы обычно составляет около 10.36 эВ, что говорит о его склонности принимать электроны и образовывать ионы. Этот процесс обеспечивает более устойчивую конфигурацию атома серы, что обуславливает его химические свойства и его участие в различных химических реакциях.
Влияние оболочки электрона на атомные свойства

Строение атома определяется его электронной оболочкой, которая состоит из энергетических уровней и подуровней. Количество электронов на каждом уровне определяется его энергией, а состояние и свойства атома зависят от взаимодействия этих электронов. Энергетические уровни разделяются на связанные с ядром энергии отрицательными зарядами и протонами ядра, которые могут принимать или отдавать электроны.
Атом натрия имеет один электрон на его последнем энергетическом уровне, который находится от ядра на достаточно большом расстоянии. Этот электрон слабо притягивается к ядру, поэтому атом натрия тенденцию отдавать этот электрон. При потере электрона, атом натрия становится ионом с положительным зарядом, и его электронные свойства изменяются. Этот процесс отдавания электрона происходит, чтобы атом натрия достиг максимальной стабильности.
Атом серы имеет шесть электронов на его последнем энергетическом уровне. Благодаря такому количеству электронов, атом серы обладает сильным электроотрицательным зарядом и способностью принимать дополнительные электроны. Когда атом серы принимает электрон, он становится отрицательно заряженным ионом, и его свойства также изменяются. Принятие электрона позволяет атому серы стабилизироваться за счет заполнения последнего энергетического уровня.
Таким образом, различное поведение атомов натрия и серы в отношении электронов объясняется их электронными оболочками. Наличие или отсутствие свободных электронов на последнем энергетическом уровне определяет способность атома принимать или отдавать электроны, что влияет на его химические свойства и реактивность.
Возможность образования ионов из атомов натрия

Атомы натрия имеют один электрон в внешней электронной оболочке. Чтобы достичь более устойчивого энергетического состояния, атом натрия может отдать этот электрон. За счет этого атом натрия может образовать положительный ион, называемый катионом.
Отдача электрона происходит из-за химической реакции с другими элементами, которые имеют свободные места для электронов в их внешней электронной оболочке. Атом натрия будет стремиться достичь более устойчивого положения, отдавая электрон и образуя ион.
Кроме того, атом натрия имеет маленькую энергию ионизации, что делает его более склонным к отдаче электрона. Это значит, что атом натрия требует небольшого количества энергии, чтобы отделить электрон от него. В результате этого процесса образуется положительно заряженный натриевый ион (Na+).
Энергия ионизации серы, наоборот, высока, что делает атом серы более склонным к принятию электронов. Атом серы имеет шесть электронов в внешней электронной оболочке и, чтобы стабилизироваться, он может получить два электрона. В результате этого процесса образуется отрицательно заряженный сульфидный ион (S2-).
Таким образом, атомы натрия и серы могут образовывать ионы из-за потребности в достижении более устойчивого энергетического состояния. Атом натрия отдает электрон, образуя положительно заряженный ион, а атом серы принимает электроны, образуя отрицательно заряженный ион.
Возможность образования ионов из атомов серы
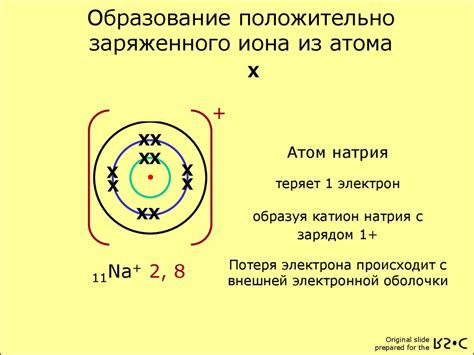
При взаимодействии с другими атомами, атом серы может принять два электрона, чтобы достичь электронной конфигурации газа инертного элемента аргон (Ar) - 1s2 2s2 2p6 3s2 3p6. Принимая два электрона, атом серы становится отрицательно заряженным ионом серы, обозначаемым как S2-.
Образование ионов из атомов серы связано с их электроотрицательностью. Сера имеет более высокую электроотрицательность по сравнению с натрием. Это значит, что атомы серы сильнее притягивают электроны, чем атомы натрия. Поэтому атомы натрия отдают электроны, чтобы достичь стабильной электронной конфигурации инертного газа, а атомы серы принимают электроны, чтобы заполнить свой последний энергетический уровень.
Реактивность атомов натрия и серы

Реактивность атомов натрия и серы определяется их электронной конфигурацией и положением в периодической системе элементов.
Атом натрия имеет электронную конфигурацию [Ne] 3s1, что означает, что в его внешней электронной оболочке находится один электрон. Такая конфигурация делает атом натрия нестабильным и склонным отдавать этот электрон, чтобы достичь более стабильного состояния. Когда атом натрия отдает свой единственный электрон, он образует ион Na+, который обладает положительным зарядом и становится более стабильным.
Атом серы имеет электронную конфигурацию [Ne] 3s2 3p4, что означает, что в его внешней электронной оболочке находятся 6 электронов. Такая конфигурация делает атом серы нестабильным и склонным принимать дополнительные электроны, чтобы достичь более стабильного состояния. Когда атом серы принимает два электрона, он образует ион S2-, который обладает отрицательным зарядом и становится более стабильным.
Таким образом, различия в реактивности атомов натрия и серы обусловлены различиями в их электронной конфигурации и стремлением к достижению более стабильного состояния через отдачу или прием электронов.



