Алмаз и графит – это две разные формы углерода, которые обладают совершенно различными свойствами и структурой. Несмотря на то, что оба вещества состоят из одного и того же химического элемента – углерода, они имеют совершенно противоположные характеристики.
Причина такого различия в свойствах алмаза и графита заключается в уникальной структуре атомов углерода в каждом из них. В алмазе атомы углерода связаны в кристаллической решетке, образуя трехмерную сетку. Каждый атом углерода тесно связан с другими атомами, образуя сильные ковалентные связи. Именно благодаря этой структуре алмаз обладает высокой твердостью, является самым твердым известным материалом.
Наоборот, графит образуется из слоев атомов углерода, которые расположены в двумерной плоскости. Между слоями атомов существуют слабые межмолекулярные силы, которые позволяют слоям графита скользить друг по другу. Именно благодаря этой структуре графит обладает смазочными свойствами и может использоваться в качестве материала для производства графитовых карандашей.
Свойства алмаза и графита: почему они отличаются?

Самое очевидное различие между алмазом и графитом - в их физической структуре. Алмаз - одна из самых твердых известных природных веществ. Его кристаллическая структура состоит из сетки атомов углерода, каждый из которых тесно связан с четырьмя соседними атомами в виде тетраэдра. Эти сильные ковалентные связи характеризуются высокой прочностью и твердостью алмаза.
В отличие от алмаза, графит представляет собой мягкий и слоистый материал. В его структуре атомы углерода образуют слои, называемые графеном, которые связаны друг с другом слабыми ван-дер-ваальсовыми силами. Эти слабые связи позволяют слоям графита скольжить друг по другу, что обуславливает его смазочные свойства и способность проводить электричество.
Другим важным отличием между алмазом и графитом является их прозрачность. Алмаз пропускает свет благодаря своей кристаллической структуре, тогда как графит является непрозрачным для видимого света из-за наличия слоистой структуры. Это объясняет различия в их внешнем виде и используется при создании ювелирных изделий и карандашей.
Структура и образование:
Углерод в алмазе организован в трехмерную кристаллическую решетку, в которой каждый атом углерода связан с четырьмя соседними атомами при помощи ковалентных связей. Это делает алмаз одним из самых твердых материалов на Земле. Он обладает высокой плотностью и прозрачностью для видимого света.
Графит, с другой стороны, имеет слоистую структуру, в которой атомы углерода связаны слабыми силами внутри плоскости слоя, но между слоями отсутствуют связи. Это делает графит мягким и смазочным материалом. В слоистой структуре графита атомы углерода организованы в шестиугольные кольца, напоминающие пчелиные гнезда.
Алмаз и графит образуются при разных условиях. Алмаз образуется в результате высокого давления и высокой температуры в земной коре на глубине от 140 до 190 километров. Графит образуется при более низких температурах и давлениях. Например, графит образуется при дегазации магмы или в процессе метаморфизма.
| Алмаз | Графит |
|---|---|
| Твердый и прозрачный | Мягкий и черный |
| Высокая плотность | Низкая плотность |
| Высокая твердость | Низкая твердость |
Кристаллическая решетка:
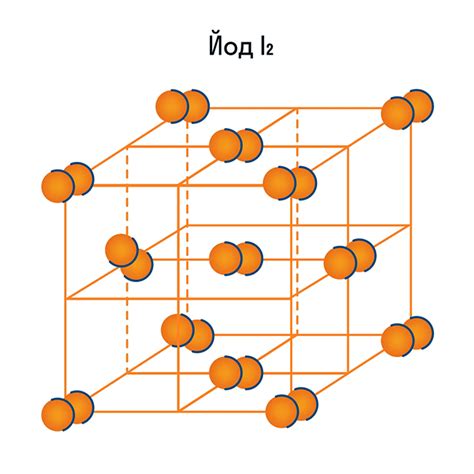
У алмаза кристаллическая решетка представляет собой трехмерную сетку атомов углерода, где каждый атом соединен с соседними атомами сильными ковалентными связями. Это создает кристаллическую решетку, которая обладает высокой прочностью и твердостью. Каждый атом углерода в алмазе связан с четырьмя другими атомами, что является источником его твердости и прочности.
С другой стороны, графит имеет кристаллическую решетку, состоящую из слоев углеродных атомов, расположенных в плоскости. Внутри каждого слоя атомы углерода тоже связаны ковалентными связями, но между слоями существуют слабые силы Ван-дер-Ваальса. Эти слабые силы позволяют слоям сдвигаться относительно друг друга, что обусловливает низкую твердость и мягкость графита.
Из-за различия в структуре и связях между атомами, алмаз и графит обладают различными свойствами, включая твердость, прочность, проводимость электричества и теплоотдачу. Алмаз является одним из самых твердых материалов, в то время как графит используется в качестве мягкого материала для письма.
Подводя итог, различия в свойствах алмаза и графита связаны с их кристаллической решеткой и взаимодействием между атомами углерода в ней.
Твердость и прочность:

Алмаз считается одним из самых твердых материалов в природе. Это объясняется его кристаллической структурой, состоящей из упорядоченной решетки атомов углерода. Каждый атом углерода связан с другими атомами через ковалентные связи, образуя очень прочную и прочную структуру. Именно благодаря такой структуре алмаз обладает свойствами твердости, из-за чего его используют в различных отраслях, таких как ювелирное дело и индустрия.
В отличие от алмаза, графит является одним из самых мягких материалов. Это происходит из-за его листоватой структуры, состоящей из слоев атомов углерода, расположенных в плоскости. Между слоями есть слабые силы Ван-дер-Ваальса, что делает графит легким для разделения на слои. Эти свойства делают графит мягким и позволяют ему использоваться в различных промышленных и консьюмерских продуктах, таких как карандаши и смазки.
- Алмаз:
- - Один из самых твердых материалов в природе
- - Прочная и упорядоченная кристаллическая структура
- - Используется в ювелирном деле и промышленности
- Графит:
- - Один из самых мягких материалов
- - Листоватая структура с слабыми силами Ван-дер-Ваальса
- - Используется в карандашах, смазках и других продуктах
Таким образом, различия в свойствах твердости и прочности между алмазом и графитом обусловлены их разной кристаллической структурой и взаимным расположением атомов углерода.
Электропроводность:
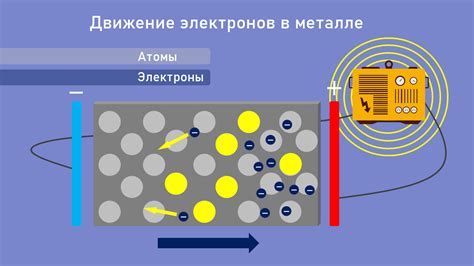
Алмаз является хорошим изолятором и не проводит электричество. Это связано с особенностями его кристаллической структуры. Каждый атом углерода в алмазе тесно связан с другими атомами через ковалентные связи. Ковалентные связи являются очень сильными и не позволяют электронам свободно двигаться. Поэтому алмаз не имеет свободных электронов и не способен проводить электрический ток.
Графит, напротив, обладает хорошей электропроводностью. В его кристаллической структуре атомы углерода образуют слои, которые слабо связаны между собой. Между слоями образуются слабые ван-дер-Ваальсовы силы, которые позволяют электронам передвигаться свободно по слоям графита. Электроны передают электрический ток от одного слоя к другому, обеспечивая электропроводность графита.
Таким образом, различные свойства алмаза и графита в отношении электропроводности определяются их кристаллическими структурами и особенностями связей между атомами углерода.
Цвет и прозрачность:

Различный цвет алмаза и графита обусловлен разными способами упаковки атомов углерода. В алмазе атомы углерода плотно упакованы в кристаллической структуре, что создает прозрачность и отражающие свойства. Графит, напротив, имеет слоистую структуру, в которой плоские слои атомов углерода располагаются параллельно друг другу и не образуют кристаллическую решетку. Это делает графит непрозрачным и даёт ему мягкость и способность оставлять "след" на поверхностях.
Таким образом, различные свойства алмаза и графита, включая цвет и прозрачность, объясняются их различной структурой и способом упаковки атомов углерода.
| Свойство | Алмаз | Графит |
|---|---|---|
| Цвет | Прозрачный, яркий | Черный или серый |
| Прозрачность | Прозрачный | Непрозрачный |
| Блеск | Яркий | Матовый |
| Твёрдость | Очень твёрдый | Мягкий |
Свойства взаимодействия:

Взаимодействие алмаза и графита с окружающей средой в значительной степени определяется их уникальной структурой и связями между атомами.
Алмаз: алмаз обладает прочной и компактной структурой, состоящей из кристаллических решеток, в которых каждый атом углерода связан с другими четырьмя атомами углерода. Эти сильные ковалентные связи обеспечивают алмазу его высокую твердость и прочность. Алмаз не реагирует с большинством химических веществ и препятствует их проникновению, что делает его хорошим изолятором электричества и пригодным для использования в ювелирной промышленности.
Однако, алмаз может реагировать с кислородом при высоких температурах, образуя углеродную кислоту. Также, алмаз может быть разрушен при высокотемпературной обработке или под действием сильных ударов.
Графит: графит имеет более сложную структуру, состоящую из плоских слоев атомов углерода, которые легко скользят друг по другу. Эти слои образуют слоистую структуру и придают графиту его мягкость и способность писать. Графит также обладает отличной электропроводимостью, что делает его полезным материалом в производстве электродов и карандашей.
Однако, графит является химически активным и может реагировать с кислородом или другими химическими веществами, образуя различные соединения. Графит также может быть изменен под действием высоких температур и давления, превращаясь в алмаз.



