Всем известно, что лед является зимней формой воды. В отличие от других веществ, вода, замерзая, расширяется, что приводит к тому, что плотность льда оказывается меньше, чем плотность жидкой воды.
Загадка этого феномена заключается в особой кристаллической структуре льда. Вода при замерзании образует регулярную решётку, в которой каждая молекула воды связана с 4 соседними молекулами посредством водородных связей. Пространство между молекулами оказывается значительным, что и объясняет увеличение объёма в замерзшей воде.
Интересный факт: именно благодаря этому свойству льда на поверхности водоёма формируется ледяная корка, которая помогает сохранять под ней жизнь в озерах и реках в холодное время года. Ведь если бы плотность льда была выше, чем плотность воды, то он тонул бы, и водоёмы бы периодически перегораживало бы толстым льдом.
Плотность льда: почему она меньше, чем у воды?

Один из самых удивительных физических свойств воды заключается в том, что плотность льда меньше, чем у воды. Это означает, что при замерзании вода увеличивает свой объем, а не уменьшает его, как большинство веществ.
При низких температурах молекулы воды начинают сближаться и образуют регулярную кристаллическую решетку. В этом состоянии молекулы воды располагаются в виде шестиугольных ячеек, образуя устойчивую структуру льда.
Кристаллическая решетка льда имеет большую межмолекулярную расстояние, чем вода в жидком состоянии. Вода в жидком состоянии имеет плотную упаковку молекул, а лед имеет более редкую, протяженную структуру.
| Свойство | Вода (жидкость) | Лед |
|---|---|---|
| Плотность | 1000 кг/м³ | 917 кг/м³ |
Разница в плотности воды и льда связана с особенностями водяных молекул. В молекуле воды каждый атом водорода соединен с атомом кислорода с помощью полярной ковалентной связи. Эти связи обусловливают положительный и отрицательный заряды областей водной молекулы, которые называются диполями.
В жидком состоянии водные молекулы постоянно движутся и взаимодействуют друг с другом. Они образуют связи водородной связи, которые облегчают перемещение молекул друг относительно друга. Это позволяет молекулам воды плотно упаковываться и образовывать жидкость.
В то время как лед также содержит водородные связи, в кристаллической решетке эти связи становятся более жесткими и ограничены в своем движении. В результате межмолекулярные расстояния увеличиваются и плотность льда уменьшается.
Интересно отметить, что уменьшение плотности льда позволяет ему плавать на поверхности воды. Это имеет большое значение для живых организмов, так как плавающий лед образует изоляционный слой, предотвращая замерзание более глубоких слоев воды и обеспечивая выживание множества форм жизни.
Таким образом, плотность льда меньше, чем у воды из-за особенностей кристаллической решетки, которая увеличивает межмолекулярные расстояния и формирует протяженную структуру льда.
Молекулярная структура воды
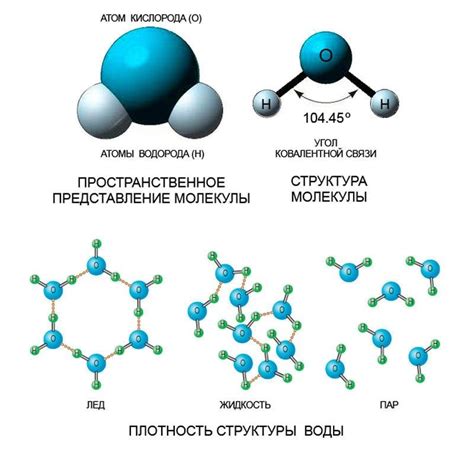
Молекулярная структура воды играет важную роль в понимании ее уникальных свойств, включая плотность льда. Вода состоит из одной кислородной атома и двух водородных атомов, соединенных с помощью ковалентных связей. Эта молекулярная структура образует угол в форме капли, известный как угол В-образи.
Ковалентная связь между кислородом и водородом воды является полярной. Кислородный атом притягивает электроны сильнее, чем водородные атомы, и создает разделение зарядов в молекуле воды. Это делает молекулу воды полярной, с положительно заряженными водородными атомами и отрицательно заряженным кислородным атомом.
Из-за полярности молекулы воды, она способна образовывать водородные связи между своими молекулами. Водородные связи образуются, когда положительно заряженный водородный атом одной молекулы притягивается к отрицательно заряженному кислородному атому соседней молекулы. Эти водородные связи делают структуру воды менее плотной и приводят к образованию кристаллической решетки при замораживании.
Водородные связи во льду образуются в определенном порядке, что приводит к формированию промежутков между молекулами воды. Эти промежутки увеличиваются при замораживании, что делает лед менее плотным, чем жидкая вода. Поэтому лед плавает на поверхности воды, так как его плотность меньше, чем плотность жидкой воды.
Межмолекулярные связи
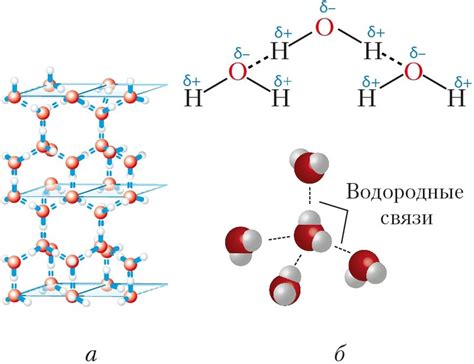
Водородная связь возникает из-за различия во взаимном притяжении положительно заряженного водородного атома одной молекулы и отрицательно заряженных атомов кислорода, азота или фтора другой молекулы. Эти электростатические взаимодействия обеспечивают стабильность структуры воды и влияют на ее свойства, включая плотность.
Вода в жидком состоянии имеет плотность около 1000 кг/м³, тогда как плотность льда составляет около 920 кг/м³. Это объясняется особенностями межмолекулярных связей в льде.
В замерзшей воде молекулы воды располагаются в решетке, где каждая молекула связана с четырьмя соседними молекулами через водородные связи. Решетка замороженной воды занимает больше объема, чем решетка жидкой воды, так как во время замерзания межмолекулярные связи образуются в фиксированной позиции и нельзя сжимать или сдвигать.
Это приводит к увеличению межмолекулярных расстояний и, следовательно, уменьшению плотности льда по сравнению с водой. Таким образом, лед плавает на поверхности воды.
Интересно, что обратное явление также наблюдается при сжатии льда. Под давлением межмолекулярные связи могут нарушаться, что приводит к уменьшению объема и увеличению плотности льда.
Образование кристаллической решетки
Кристаллическая решетка льда обладает определенным порядком и симметрией. Молекулы воды организуются в гексагональные структуры, в которых каждая молекула соседствует с шестью другими. Это создает устойчивую опору, из-за которой лед имеет Форму и объем.
Образование кристаллической решетки связано с изменением взаимного расположения молекул воды при замерзании. При понижении температуры между молекулами воды возникают слабые взаимодействия, называемые водородными связями. Они притягивают молекулы друг к другу и способствуют образованию кристаллической решетки.
Особенность кристаллической решетки льда заключается в том, что в решетку встраиваются не все молекулы воды. Вместо этого каждая вторая пустая позиция в решетке занимается небольшим волновым движением молекул, что вызывает увеличение объема решетки и, следовательно, уменьшение плотности льда по сравнению с водой.
В итоге, образование кристаллической решетки приводит к уменьшению плотности льда, по сравнению с водой, и позволяет льду плавать на воде, сохраняя на поверхности тепло и поддерживая стабильность температуры в подводном мире.
Компактность молекулярной упаковки

Плотность вещества определяется количеством массы, содержащейся в единице объема. В случае с льдом и водой, несмотря на то, что молекулы воды остаются теми же, плотность льда оказывается меньше, чем плотность воды. Это связано с особенностями молекулярной упаковки во время кристаллизации.
Когда вода замерзает, молекулы начинают образовывать регулярную решетку, где каждая молекула воды связана с другими четырьмя молекулами посредством водородных связей. Расстояние между молекулами при этом увеличивается, в результате чего вода расширяется и образует лед.
Важно отметить, что вода является одним из немногих веществ, которое обладает возможностью плотности сверхухолодного состояния. Это значит, что при определенных условиях, вода может оставаться в жидком состоянии при температуре ниже точки замерзания. При замораживании такой воды происходит экзотермический процесс и она моментально проходит в кристаллическую фазу.
Молекулярная упаковка в льду формирует кристаллическую решетку, в которой молекулы воды занимают определенные позиции, оставляя между собой достаточно большие промежутки относительно объема, который они занимают в жидком состоянии. Именно благодаря этой особенности лед оказывается менее плотным, чем жидкая вода.
Интра- и интермолекулярные связи

Интрамолекулярные связи - это связи, которые образуются между атомами в одной молекуле. В случае воды, интрамолекулярные связи образуются между кислородом и водородом внутри одной молекулы. Эти связи являются полярными и обусловлены разностью в электроотрицательностях атомов. В результате образуется диполь молекулы воды, что делает молекулы воды полярными.
| Интрамолекулярные связи в молекуле воды | Характеристика |
|---|---|
| Водородная связь | Образуется между кислородом одной молекулы и водородом соседней молекулы воды |
| Ковалентная связь | Образуется между кислородом и двумя водородами внутри одной молекулы воды |
Интермолекулярные связи - это связи, которые образуются между молекулами. Вода образует слабые межмолекулярные силы, которые называются водородными связями. Водородные связи образуются между положительно заряженным водородным атомом одной молекулы и отрицательно заряженным кислородным атомом соседней молекулы. Эти водородные связи обеспечивают особо прочные и устойчивые структуры.
Интра- и интермолекулярные связи вместе обусловливают решающую роль в особенностях поведения воды. В жидком состоянии молекулы воды находятся близко друг к другу и образуют нерегулярную структуру, присущую жидким веществам. Однако, при охлаждении вещества ниже точки замерзания, молекулы воды начинают формировать упорядоченную структуру при образовании кристаллической решетки льда. Вода в жидком состоянии имеет более высокую плотность из-за близкого расположения молекул, в то время как лед имеет меньшую плотность из-за расширения пространства между молекулами, вызванного образованием водородных связей.
Открытая кристаллическая структура

Вода имеет атомарную структуру, то есть каждый молекула воды состоит из двух атомов водорода и одного атома кислорода. При охлаждении вода начинает образовывать кристаллическую структуру, превращаясь в лед.
Однако, в отличие от большинства веществ, лед обладает открытой кристаллической структурой, которая состоит из регулярно расположенных водных молекул. В результате образуется сеть, в которой между молекулами формируются просторные полости и пустоты.
Эти пустоты приводят к увеличению объема льда по сравнению с водой. Вода плотно упаковывается, молекулы располагаются на меньшем расстоянии друг от друга, что обуславливает ее большую плотность. В то же время, лед имеет более разреженную структуру, молекулы находятся на большем расстоянии, что приводит к уменьшению плотности льда.
Открытая кристаллическая структура льда также обеспечивает его особые свойства, такие как высокая прочность и прозрачность. Кристаллическая сетка льда также не позволяет более крупным молекулам и ионам эффективно проникать в эту структуру, делая лед химически стабильным.
Влияние на природные процессы

Этот феномен играет важную роль в сохранении живых организмов, обитающих в воде. Плывущий лед защищает воду от полного замерзания, формируя тонкую теплоизолирующую поверхность. Это позволяет животным и растениям водной среды выжить в холодные зимние месяцы.
Плотность льда также влияет на климатические процессы. Моря и океаны, покрытые льдом, отражают большое количество солнечного излучения обратно в космическое пространство, что способствует охлаждению атмосферы. Этот процесс существенно влияет на регуляцию климата на планете.
Кроме того, изменение плотности при переходе воды к ледяному состоянию влияет на гидродинамические процессы в океанах и водных потоках. Учитывая, что лед плавает на поверхности, он оказывает сдерживающий эффект на промерзание водоемов, создавая естественные барьеры для движения ледяных массивов.
Таким образом, плотность льда играет важную роль в природных процессах, оказывая влияние на организмы, климат и гидродинамические характеристики водной среды.



