Перенос вещества – это явление, при котором ионы или молекулы перемещаются в растворе электролита или через него под воздействием электрического тока. Это явление основано на принципах электрохимии, и играет важную роль в различных процессах и технологиях, включая электролиз, электроосаждение, электрофорез и другие.
Основным фактором, определяющим перенос вещества, является наличие электролитической проводимости в растворе. Электролитическая проводимость обусловлена наличием ионов в растворе электролита. В процессе диссоциации электролита, ионы образуются и, благодаря своему заряду, могут двигаться под воздействием электрического поля.
Перенос вещества в растворе электролита основан на двух основных механизмах: в электролитах с противоположными зарядами ионы перемещаются в разные стороны под воздействием электрического тока, в результате чего происходит разделение зарядов. В электролитах с одноименными зарядами ионы перемещаются более активных веществ в сторону укладки, вызывая так называемую электроосмотическую перемещение или электрофорез.
Причины переноса вещества

Перенос вещества в растворе электролита при прохождении тока возникает из-за двух основных явлений: электролиза и конвекции.
Электролиз – это процесс разложения растворенного электролита под воздействием электрического тока. Электрический ток, протекая через раствор, вызывает перемещение ионов электролита к электродам. Ионы с положительным зарядом притягиваются к отрицательно заряженному электроду (катоду), а ионы с отрицательным зарядом - к положительно заряженному электроду (аноду). Этот процесс приводит к переносу вещества через раствор.
Конвекция – это явление, при котором возникают перемещения частиц вещества под воздействием разности концентраций и температур. При прохождении тока через раствор электролита происходят химические реакции, которые могут вызывать изменение температуры и концентрации вещества в растворе. Вследствие этого возникают конвекционные потоки, которые также способствуют переносу вещества через раствор.
Таким образом, перенос вещества при прохождении тока через раствор электролита объясняется как электролизом, так и конвекцией, которые обусловлены воздействием электрического тока на растворенный электролит.
Воздействие тока на раствор электролита
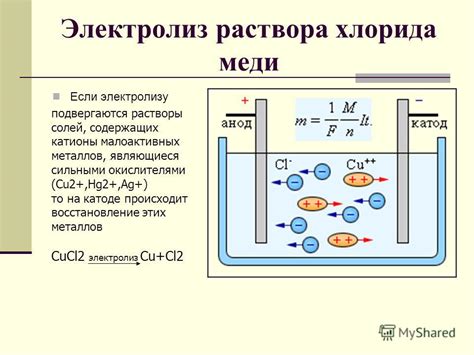
Перенос ионов происходит благодаря двум основным явлениям - электролизу и диффузии.
Электролиз - процесс, при котором ионы мигрируют к электродам. Положительные ионы двигаются к отрицательному электроду (катоду), а отрицательные ионы - к положительному электроду (аноду). При достижении электрода ионы могут производить различные химические реакции, что приводит к образованию или освобождению вещества.
Диффузия - процесс перемешивания ионов электролита, который происходит благодаря разнице их концентраций. В результате этого процесса, ионы распределяются равномерно по объему раствора.
Оба этих процесса - электролиз и диффузия - являются основой переноса вещества при прохождении тока через раствор электролита. Они играют важную роль в многих электрохимических реакциях, таких как электролиз воды или гальванические элементы.
| Положительный электрод (катод) | Отрицательный электрод (анод) |
|---|---|
| Притягивает отрицательные ионы | Притягивает положительные ионы |
| Место формирования вещества | Место, где вещество растворяется |
В целом, воздействие тока на раствор электролита приводит к переносу ионов и образованию или расходованию вещества при электролизе.
Поляризация и ионы в растворе
При прохождении тока через раствор электролита происходит перемещение ионов под действием электрического поля. Однако в процессе движения ионов возникает явление, называемое поляризацией.
Поляризация – это процесс, при котором ионы, находящиеся в растворе, а также ионы электролита, соприкасающегося с электродом, ориентируются под воздействием электрического поля.
Электрическое поле вызывает поляризацию ионных оболочек, заключающих ионы в растворе. Под действием поля эти ионные оболочки начинают смещаться в противоположную сторону от электрода, что препятствует их движению в том же направлении, что и поляризованный электрод.
Происходящая поляризация в растворе приводит к изменению концентрации ионов у поверхности электрода и созданию электродного двойного слоя – области, где концентрация ионов отличается от концентрации в объеме раствора.
Для учета эффекта поляризации в процессе переноса ионов через электролит необходимо учитывать не только скорость их движения под действием электрического поля, но и изменение их концентрации у поверхности электродов.
| Слой | Заряд |
|---|---|
| Поверхность электрода | Отрицательный заряд |
| Область поляризации | Положительный заряд |
| Объем раствора | Нейтральный заряд |
Это изменение концентрации ионов у поверхности электродов и создаёт электродный потенциал ионов в окрестности электрода. Оно также влияет на величину сопротивления электролита и его электропроводность.
Различные факторы, влияющие на перенос вещества
Перенос вещества при прохождении тока через раствор электролита зависит от нескольких факторов, которые могут влиять на его направление и скорость.
- Разность потенциалов
- Концентрация электролита
- Температура раствора
- Площадь электродов
- Поляризация электрода
Одним из основных факторов, влияющих на перенос вещества, является разность потенциалов между электродами, через которые проходит ток. Если разность потенциалов высока, то перенос вещества будет более интенсивным.
Концентрация электролита в растворе также имеет большое значение для переноса вещества. Чем выше концентрация электролита, тем интенсивнее будет перенос вещества.
Температура раствора электролита может оказывать влияние на скорость переноса вещества. Обычно, с увеличением температуры раствора увеличивается скорость переноса вещества.
Площадь электродов, между которыми происходит перенос вещества, также может влиять на его скорость. Большая площадь электродов способствует более интенсивному переносу вещества.
Поляризация электрода возникает в результате химических процессов, происходящих на его поверхности. Она может оказывать как положительное, так и отрицательное влияние на перенос вещества.
Роль концентрации вещества в растворе
Концентрация вещества в растворе играет важную роль в процессе переноса вещества при прохождении тока через электролит. Концентрация определяет количество растворенных частиц в единице объема раствора. Чем выше концентрация, тем больше растворенных частиц и тем эффективнее происходит перенос вещества.
При прохождении тока через раствор электролита, положительно и отрицательно заряженные ионы движутся в противоположных направлениях под действием электрического поля. Концентрация ионов оказывает влияние на скорость переноса вещества и электролитическую проводимость раствора.
Высокая концентрация вещества в растворе сопровождается большим количеством ионов, что ведет к увеличению скорости переноса вещества и повышению электролитической проводимости. Это объясняется тем, что большое количество частиц в растворе создает большую возможность для столкновения ионов между собой и со средой, что способствует более быстрому движению ионов.
С другой стороны, низкая концентрация вещества в растворе приводит к меньшему количеству ионов и, следовательно, меньшей скорости переноса вещества и низкой электролитической проводимости. Это связано с ограничением возможностей столкновений между ионами, что замедляет их движение в растворе.
Таким образом, концентрация вещества в растворе является важной переменной, которая влияет на процесс переноса вещества при прохождении тока через электролит. Высокая концентрация способствует более быстрому переносу вещества и повышенной проводимости, в то время как низкая концентрация приводит к медленному переносу и низкой проводимости.
Эффекты прохождения тока через раствор
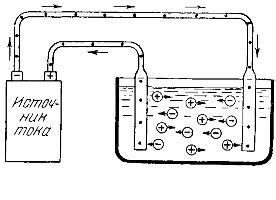
Прохождение электрического тока через раствор электролита вызывает ряд химических и физических эффектов, которые имеют важное значение в различных процессах и технологиях. Вот некоторые из этих эффектов:
- Электролиз. При пропускании постоянного тока через раствор электролита происходит разложение веществ на ионы, положительные ионы перемещаются к отрицательному электроду, а отрицательные ионы - к положительному. Этот процесс называется электролизом и является основой для многих электрохимических реакций.
- Перенос массы. При прохождении тока через раствор электролита происходит перенос вещества. Это связано с тем, что ионы проводят электрический ток и перемещаются в направлении силы тока. Перенос массы играет важную роль в процессах электроосаждения, гальванической коррозии и других электрохимических процессах.
- Изменение pH. Прохождение тока через раствор электролита может изменить pH среды. Например, при электролизе воды в растворе образуются водородные и гидроксильные ионы, что приводит к изменению pH раствора. Этот эффект используется в различных электрохимических методах анализа и очистки воды.
- Образование электрического поля. Прохождение тока через раствор электролита создает электрическое поле вокруг проводящих электродов. Это поле может влиять на перемещение ионов и кинетику электрохимических реакций. Кроме того, электрическое поле может использоваться для разделения и концентрирования ионов в различных процессах.
В целом, прохождение тока через раствор электролита является сложным процессом, объяснение которого требует учета различных физико-химических явлений. Изучение этих эффектов и их взаимосвязей является важной задачей современной электрохимии и применяется во многих сферах науки и техники.
Закон Нернста и перенос вещества

Согласно закону Нернста, скорость переноса заряженных частиц (ионов) через электролитическую ячейку определяется разностью потенциалов между анодом и катодом, а также концентрацией растворенного вещества. Уравнение Нернста позволяет рассчитать потенциал на электроде при заданных условиях:
- Потенциал на электроде (E) определяется разностью стандартного потенциала электродной пары (E°) и суммой произведений концентраций ионов (C) на их заряды (z):
E = E° + (RT/zF) * ln(C)
- E - потенциал на электроде;
- E° - стандартный потенциал электродной пары;
- R - универсальная газовая постоянная;
- T - температура в кельвинах;
- z - заряд иона;
- F - фарадаи.
- Закон Нернста позволяет определить направление движения ионов в электролитической ячейке. Если значение потенциала (E) меньше потенциала равновесия (E°), то ионы будут двигаться от анода к катоду. Если значение потенциала (E) больше потенциала равновесия (E°), то ионы будут двигаться от катода к аноду.
Закон Нернста играет важную роль в понимании электрохимических реакций и процессов, таких как гальванические элементы, электролиз и коррозия металлов. При изучении электролитических явлений необходимо учитывать условия, описываемые этим законом, для более точного прогнозирования и анализа электрохимических систем.
Применение переноса вещества в практике

Перенос вещества при прохождении тока через раствор электролита имеет множество практических применений. Некоторые из них включают:
Электродефицитное осаждение металлов: При использовании метода электролиза, знание о переносе вещества позволяет контролировать и управлять осаждением металлов на электроде. Это применяется, например, в производстве чистых и качественных покрытий металлов на различных поверхностях.
Электрохимические датчики: В электрохимических датчиках используется изменение свойств раствора электролита при прохождении тока. Это позволяет измерять концентрацию определенных веществ, таких как газы или ионы, в растворе.
Электрофорез: Метод электрофореза основан на перемещении частиц в растворе под воздействием электрического поля. Перенос вещества играет важную роль в этом процессе, позволяя разделять и чистить различные вещества по размеру и заряду частиц.
Электроосаждение покрытий: Этот метод используется для нанесения защитных или декоративных покрытий на различные поверхности. При этом перенос вещества помогает равномерно распределить материал на поверхности, что создает прочное и качественное покрытие.
Все эти применения переноса вещества при прохождении тока через раствор электролита играют важную роль в различных сферах, таких как производство, аналитика, медицина и другие. Понимание и управление переносом вещества позволяет создавать новые технологии и улучшать существующие процессы.



