Вода - одно из самых распространенных веществ на Земле. Ее уникальные свойства делают ее не только необходимой для жизни, но и исследуемой наукой уже веками. Однако, помимо жидкой формы, вода может находиться также в газообразном состоянии, известном как водяной пар.
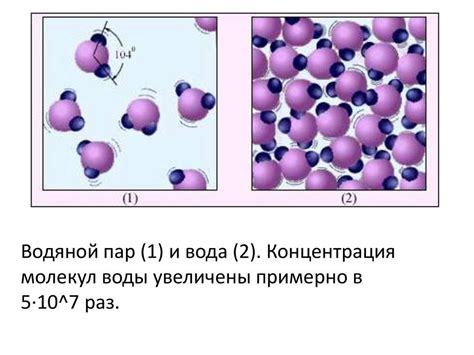
Отличия молекул воды и водяного пара заключаются в их структуре и движении. В молекулах воды, состоящих из двух атомов водорода и одного атома кислорода, атомы связаны ковалентными связями. Эти связи образуют угловую форму молекулы и создают полярность, которая определяет многие свойства воды. Водяной пар, или вода в газообразном состоянии, состоит из отдельных молекул воды, которые свободно движутся и разделены друг от друга.
Когда вода нагревается, ее молекулы получают больше энергии и начинают двигаться быстрее. Это позволяет некоторым молекулам преодолеть межмолекулярные связи и перейти в газообразное состояние, образуя водяной пар. Один из ключевых факторов, определяющих состояние воды, - это ее температура. При низких температурах вода находится в твердом состоянии - льду, а при повышении температуры она становится жидкой. При дальнейшем нагреве, когда температура достигает точки кипения (100 градусов Цельсия на уровне моря), большая часть воды превращается в водяной пар.
Отличия молекул воды и водяного пара
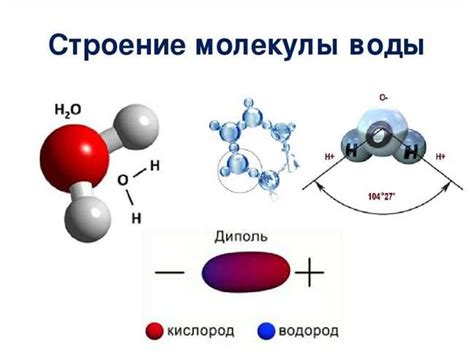
Молекулы воды и водяного пара имеют ряд характеристик, которые определяют их состояние и поведение. Вот некоторые основные отличия между ними:
- Состав: Молекула воды состоит из двух атомов водорода и одного атома кислорода, образуя химическую формулу H2O. Водяной пар состоит из пары молекул воды.
- Связи: В молекуле воды атомы связаны ковалентными связями, образуя угловатую структуру. Водяной пар также образует слабые межмолекулярные взаимодействия, такие как водородные связи.
- Форма: Молекулы воды имеют преимущественно жидкую форму, хотя они также могут существовать в твердом (льде) и газообразном (водяной пар) состоянии. Водяной пар, напротив, является газообразным состоянием воды, когда ее температура достигает точки кипения.
- Поведение: Молекулы воды обладают свойствами капиллярной активности, адгезии и когезии, а также умеют изменять свою температуру с выделянием или поглощением тепла. Водяной пар обладает свойствами диффузии и экспансии.
- Плотность: Плотность молекул воды выше, чем у водяного пара. Это связано с разными степенями сжимаемости этих состояний.
- Потенциал: В молекуле воды есть потенциал образования водородных связей с другими молекулами воды или другими веществами. Водяной пар имеет высокий потенциал для дальнейшей конденсации и образования жидкой воды.
Эти отличия не только определяют различное поведение воды и водяного пара, но и играют важную роль в множестве естественных процессов, таких как погода, циркуляция воды в природе и физические свойства водных систем.
Структура молекул воды и водяного пара

С другой стороны, водяной пар состоит из отдельных молекул воды, которые находятся в газообразном состоянии. Когда вода нагревается, молекулы воды приобретают дополнительную энергию и начинают двигаться быстрее. Это приводит к разрыву слабых ковалентных связей между молекулами воды и образованию пара. В результате, водяной пар становится газом, состоящим из отдельных молекул воды, которые могут свободно двигаться и занимать большие объемы.
Таким образом, структура молекул воды и водяного пара различается. В молекуле воды атомы водорода и кислорода связаны прочными ковалентными связями, образуя молекулу с определенной формой и полярностью. Водяной пар, с другой стороны, представляет собой газ, состоящий из отдельных молекул воды, которые движутся свободно и не связаны между собой. Определенные свойства воды и водяного пара также обусловлены различной структурой их молекул.
Связь между молекулами воды и водяного пара
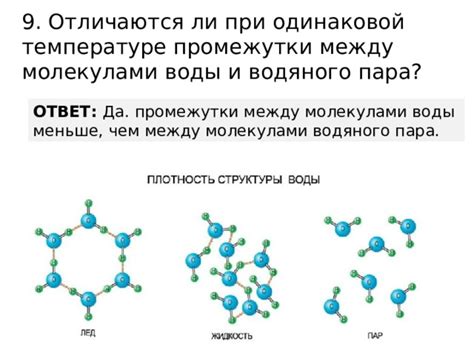
Молекулы воды и водяного пара обладают особыми свойствами и по-разному взаимодействуют друг с другом.
Молекулы воды (H2O) находятся в жидком состоянии при комнатной температуре и давлении. Они образуют сеть водородных связей, которые являются важным фактором, определяющим их уникальные свойства. Водородные связи возникают благодаря электростатическому притяжению между положительно заряженным водородным атомом одной молекулы и отрицательно заряженными атомами кислорода соседних молекул.
Водяной пар (H2O (газ)) образуется при переходе молекул воды из жидкого состояния в газообразное. В этом случае молекулы воды обладают достаточной энергией, чтобы преодолеть притяжение между собой и облететь свободно в окружающем пространстве. Таким образом, водяной пар состоит из отдельных молекул, не связанных друг с другом водородными связями.
Связь между молекулами воды и водяного пара определяется энергией и температурой системы. При повышении температуры молекулы воды получают больше энергии, разбивают водородные связи и переходят в состояние водяного пара. При охлаждении, наоборот, молекулы водяного пара теряют энергию и снова образуют сеть водородных связей в жидком состоянии воды.
Связь между молекулами воды и водяного пара также зависит от давления. При повышении давления, например, в закрытой системе, молекулы воды образуют воду, чтобы снизить объем и уменьшить количеством свободного пространства для движения. При понижении давления, например, при открытии крышки, молекулы воды обретают достаточно энергии, чтобы преодолеть силы притяжения и перейти в газообразное состояние водяного пара.
Физические свойства воды и водяного пара
| Свойство | Вода | Водяной пар |
|---|---|---|
| Температура кипения | 100°C | Зависит от давления (100°C при атмосферном давлении) |
| Температура замерзания | 0°C | Зависит от давления (0°C при атмосферном давлении) |
| Плотность | Высокая | Меньше по сравнению с водой |
| Форма | Принимает форму контейнера | Принимает форму среды в которой находится |
| Скорость движения молекул | Медленная | Быстрая |
| Фазовые переходы | Имеет три фазы - твердую, жидкую и газообразную | Есть только одна фаза - газообразная |
Таким образом, хотя молекулы воды и водяного пара являются одинаковыми (H2O), различное расположение и движение этих молекул определяют их физические свойства и состояние.
Температурные условия, при которых образуется пар

Пар образуется из воды при определенных температурных условиях. Молекулы воды в жидком состоянии двигаются неупорядоченно, но при достижении определенной критической температуры, которую называют температурой кипения, и при наличии достаточного давления, молекулы воды приобретают достаточно энергии, чтобы преодолеть силы взаимодействия и перейти в газообразное состояние.
Температурные условия для образования пара зависят от давления в окружающей среде. Например, на уровне моря при нормальном атмосферном давлении вода начинает кипеть при температуре 100°C. Однако, при пониженных давлениях, таких как на высоте, температура кипения воды также понижается.
Водяной пар может образовываться не только при кипении воды, но и при испарении при более низких температурах. Водяной пар может образовываться при любой температуре ниже 100°C, при условии, что вода находится в открытом пространстве и имеет достаточно энергии, чтобы преодолеть силы взаимодействия между молекулами и перейти в газообразное состояние.
Влияние давления на образование пара
Вода в жидком состоянии содержит молекулы, которые постоянно движутся и сталкиваются друг с другом. При повышении давления на поверхность воды, количество молекул, которые обладают достаточной кинетической энергией для перехода в газообразное состояние, увеличивается. Это происходит из-за того, что при повышении давления увеличивается сила соударений между молекулами, что способствует переходу большего числа молекул в пар.
Напротив, если давление на поверхность воды снижается, меньшее количество молекул обладает достаточной кинетической энергией для перехода в газообразное состояние. Это происходит из-за того, что при снижении давления силы соударений между молекулами уменьшаются, что затрудняет образование пара.
Таким образом, давление оказывает прямое влияние на образование пара из жидкости. Повышение давления способствует большему количеству молекул, переходящих в газообразное состояние, в то время как снижение давления затрудняет это образование.
Фазовый переход воды в пар и наоборот
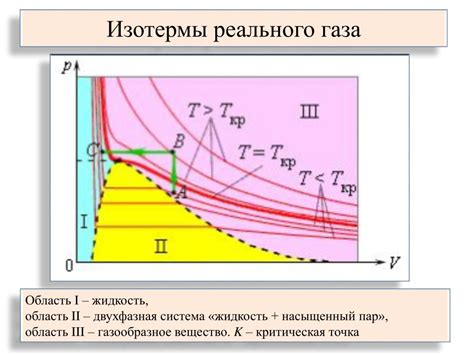
Когда температура воды достигает точки кипения (100 градусов Цельсия при стандартном атмосферном давлении), молекулы воды получают достаточно энергии, чтобы преодолеть притяжение друг к другу и перейти в состояние пара. В этом состоянии молекулы воды разлетаются в пространстве, образуя газообразную субстанцию.
Обратный процесс, т.е. конденсация пара обратно в воду, происходит при охлаждении водяных паров. При снижении температуры, молекулы водяного пара теряют энергию и начинают притягиваться друг к другу. При достаточно низкой температуре, эти молекулы начинают образовывать жидкую фазу воды.
Фазовый переход воды в пар и обратно - это важный процесс, который имеет огромное значение в природе. Он играет ключевую роль в цикле воды в природе и является основой для образования облаков, осадков и других видов водных образований.
Изменение плотности воды и водяного пара при изменении температуры и давления

При изменении температуры и давления происходят значительные изменения плотности воды и водяного пара. Обычно при повышении температуры плотность воды уменьшается, а при понижении температуры - увеличивается.
Повышение давления также влияет на плотность воды и водяного пара. Водяной пар под давлением обычно имеет меньшую плотность, чем при нормальных условиях (1 атмосферное давление), в то время как у воды плотность увеличивается при давлении.
Эти изменения плотности воды и водяного пара имеют важное значение для различных явлений и процессов, включая плавание и всплытие тел в воде, атмосферные осадки, фазовые переходы и многие другие.
Понимание этих изменений плотности помогает ученым в изучении и прогнозировании различных природных явлений и технологических процессов, а также в разработке новых материалов и технологий.
Водяной пар в окружающей среде и его роль

Водяной пар является одним из основных компонентов атмосферы Земли. Он образуется благодаря испарению воды из морей, океанов, рек и озер, а также благодаря процессам, происходящим в растениях и почве. Водяной пар поднимается вверх и образует облака. Затем под воздействием различных физических и химических процессов он может конденсироваться и выпадать в виде осадков – дождя, снега, града.
Водяной пар также играет важную роль в глобальном климате Земли. Он является одним из основных парниковых газов, среди которых также находятся диоксид углерода, метан и оксид азота. Парниковые газы задерживают тепло, излучаемое Землей, что приводит к повышению температуры атмосферы и вызывает явление глобального потепления.
Водяной пар играет важную роль в биологических процессах. Он является непосредственным источником воды для растений, которые через процесс испарения и транспирации поглощают воду из почвы. Водяной пар также влияет на регуляцию температуры в живых организмах: при испарении воды с поверхности кожи или листьев происходит охлаждение, что помогает снизить температуру организма.
Водяной пар в окружающей среде важен для многих технических и промышленных процессов. Он используется в производстве электричества, при дистилляции, при производстве пищевых продуктов, в медицине и других отраслях. Также водяной пар играет важную роль в системе охлаждения технических устройств, например, в парогенераторах.
Водяной пар в окружающей среде имеет свою уникальную роль и важность. Он является неотъемлемой частью нашей жизни и оказывает влияние на окружающий мир.
Практическое применение молекул воды и водяного пара
Молекулы воды и водяной пар используются в множестве областей нашей жизни и оказывают значительное влияние на окружающую среду.
Вода является жизненно важным элементом для всех организмов на Земле и используется в различных сферах деятельности. Молекулы воды используются в пищевой промышленности для приготовления пищи, в производстве напитков и в косметической промышленности для создания различных товаров для ухода за кожей и волосами.
Молекулы воды и водяного пара также применяются в медицинских целях. Водяные пары используются для ингаляций и создания специальных аппаратов для ингаляционной терапии. Молекулы воды играют важную роль в организме человека, участвуя в процессах обмена веществ и поддерживая гомеостаз в организме.
В целом, практическое применение молекул воды и водяного пара неоценимо и находится во многих сферах жизни, от промышленности до медицины. Это подчеркивает важность понимания состояния и свойств этих молекул для более эффективного использования их в нашей повседневной жизни.



